Lösung zu Kreisprozess mit Helium: Unterschied zwischen den Versionen
Inhalt hinzugefügt Inhalt gelöscht
Admin (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
Admin (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 1: | Zeile 1: | ||
<gallery> |
<gallery> |
||
| ⚫ | |||
Bild:Kreisprozess Helium T-S-Diagramm.gif|''T-S-''Diagramm |
Bild:Kreisprozess Helium T-S-Diagramm.gif|''T-S-''Diagramm |
||
| ⚫ | |||
</gallery> |
</gallery> |
||
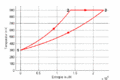
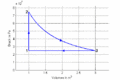
#Im ''T-S-''Diagramme verläuft die isochore Zustandsänderung exponentiell, die isotherme horizontal und die isobare wiederum exponentiell. Im ''p-V-''Diagramm steigt die Kurve zuerst vertikal nach oben, läuft dann auf einer Hyperbel (<math>pV=p_0V_0</math>) nach rechts unten und zum Schluss auf einer Horizontalen nach links. Im ''T-S-''Diagramm entspricht die Fläche unter der Kurve eines Teilprozesses der Wärme. Im ''p-V-''Diagramm ergibt die entsprechende Fläche die (negativ genommene) Arbeit. |
#Im ''T-S-''Diagramme verläuft die isochore Zustandsänderung exponentiell, die isotherme horizontal und die isobare wiederum exponentiell. Im ''p-V-''Diagramm steigt die Kurve zuerst vertikal nach oben, läuft dann auf einer Hyperbel (<math>pV=p_0V_0</math>) nach rechts unten und zum Schluss auf einer Horizontalen nach links. Im ''T-S-''Diagramm entspricht die Fläche unter der Kurve eines Teilprozesses der Wärme. Im ''p-V-''Diagramm ergibt die entsprechende Fläche die (negativ genommene) Arbeit. |
||
Version vom 4. April 2008, 09:35 Uhr
-
T-S-Diagramm
-
p-V-Diagramm
- Im T-S-Diagramme verläuft die isochore Zustandsänderung exponentiell, die isotherme horizontal und die isobare wiederum exponentiell. Im p-V-Diagramm steigt die Kurve zuerst vertikal nach oben, läuft dann auf einer Hyperbel ([math]pV=p_0V_0[/math]) nach rechts unten und zum Schluss auf einer Horizontalen nach links. Im T-S-Diagramm entspricht die Fläche unter der Kurve eines Teilprozesses der Wärme. Im p-V-Diagramm ergibt die entsprechende Fläche die (negativ genommene) Arbeit.
- Das universelle Gasgesetz liefert für den unteren Druck einen Wert von 249 bar. Der Druck nach dem Aufheizen beträgt 748 bar.
- Im ersten Prozess nimmt die Entropie um [math]\Delta S=n\hat c_V\ln{\frac{T_2}{T_1}}=\frac 3 2 nR\ln{\frac{T_2}{T_1}}[/math] = 137 kJ/K zu. Im dritten, isobaren Teilprozess nimmt die Entropie um 5/3 dieses Wertes, also um 228 kJ/K ab, weil die Wärmekapazität bei konstantem Druck um diesen Wert grösser als die Wärmekapazität bei konstantem Volumen ist. Die Differenz von 91 kJ/K muss im isothermen Prozess aus einem Wärmebad zugeführt werden.
- Im ersten Prozess nimmt die innere Energie des Heliums um [math]W_{therm12}=\Delta W=\frac{3}{2}nR\Delta T[/math] = 74.8 MJ zu. Bei der nachfolgenden isothermen Zustandsänderung muss dem Gas zusätzliche Energie in Form von Wärme zugeführte werden [math]W_{therm23}=nRT_2\ln{\frac{V_2}{V_3}}[/math] = 82.2 MJ (bei einer isothermen Expansion bleibt die Entropie, welche die Energie trägt, im Gas drin; die Energie geht dagegen direkt in Form von Arbeit weg). Um die Energie für diese beiden Teilprozesse aus dem Ofen abzutransportieren, muss der Ofen die folgende Entropiemenge abgeben [math]S_{Ofen}=\frac{W_{therm13}}{T_{Ofen}}=\frac{157 kJ}{1000 K}[/math] = 157 J/K. Im dritten Teilprozess, dem isobaren, wird die eine bestimmte Energiemenge in Form von Wärme abgeführt [math]W_{therm31}=\frac 5 2 nR \Delta T[/math] = 125 MJ. Diese Energie muss bei einer Temperatur von 280 K von der Entropie [math]S_{Um}=\frac{W_{therm31}}{T_{Um}}[/math] = 445 kJ/K in die Umwelt hinein getragen werden. Erzeugt wird die Differenz zwischen der von Umwelt aufgenommenen und der vom Ofen abgegebenen Entropie. Diese Differenz beträgt 288 kJ/K.