Lösung zu Luftspeicher: Unterschied zwischen den Versionen
Inhalt hinzugefügt Inhalt gelöscht
Keine Bearbeitungszusammenfassung |
Keine Bearbeitungszusammenfassung |
||
| Zeile 4: | Zeile 4: | ||
</gallery> |
</gallery> |
||
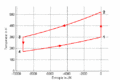
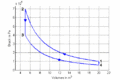
#Im ''T-S-''Diagramm bilden die Isentropen vertikale Linien, die Isochoren verlaufen exponentiell in Funktion der Entropie oder logarithmisch mit der Temperatur. Im ''p-V-''Diagramm schneiden die Isentropen die Isothermen unter einem spitzen Winkel, die Isochoren verlaufen vertikal. |
#Im ''T-S-''Diagramm bilden die Isentropen vertikale Linien, die Isochoren verlaufen exponentiell in Funktion der Entropie oder logarithmisch mit der Temperatur. Im ''p-V-''Diagramm schneiden die Isentropen die Isothermen unter einem spitzen Winkel, die Isochoren verlaufen vertikal. |
||
#Am Ende des ersten Teilprozesses beträgt der Druck <math>p_2=p_1\left(\frac {V_1}{V_2}\right)^\kappa</math> = 1 bar * (20 |
#Am Ende des ersten Teilprozesses beträgt der Druck <math>p_2=p_1\left(\frac {V_1}{V_2}\right)^\kappa</math> = 1 bar * (20 m<sup>3</sup> / 5 m<sup>3</sup>)<sup>1.4</sup> = 6.96 bar und die Temperatur ist gleich <math>T_2=T_1\frac{p_2V_2}{p_1 V_1}</math> = 300 K * (6.96 bar * 5 m<sup>3</sup>)/(1 bar * 20 m<sup>3</sup>) = 522 K. Nach dem zweiten Teilprozess betragen das Volumen V<sub>3</sub> = 5 m<sup>3</sup>, die Temperatur T<sub>3</sub> = 300 K und der Druck p<sub>3</sub> = p<sub>1</sub> * V<sub>1</sub> / V<sub>3</sub> = 1 bar * 20 m<sup>3</sup> / 5 m<sup>3</sup> = 4 bar. Nach dem dritten Teilprozess beträgt der Druck nur noch <math>p_4 = p_3\left(\frac {V_3}{V_4}\right)^\kappa</math> = 4 bar * (5 m<sup>3</sup> / 20 m<sup>3</sup>)<sup>1.4</sup> = 0.574 bar und die Temperatur misst <math>T_4 = T_3 \frac{p_4 V_4}{p_3 V_3}</math> = 300 K * (0.574 bar * 20 m<sup>3</sup>)/(4 bar * 5 m<sup>3</sup>) = 172 K. Für die Berechnung dieser Werte geht man am besten vom Anfangszustand des isentropen Teilprozesses aus und verwendet dann die Isentropengleichung und die thermische Zustandsgleichung. |
||
#Die Arbeit bei den isentropen |
#Die Arbeit bei den isochoren Teilprozesse ist 0. Die Arbeit bei den isentropen Teilprozessen ist gleich der Änderung der inneren Energie. Diese hängt wiederum nur von der Temperatur ab <math>W_{tot}=W_{12}+W_{34}=n\hat c_V(T_2-T_1+T_4-T_3)=n\hat c_V(T_2+T_4-2T_1)</math> = 802 mol * = 1.57 MJ. Die Stoffmenge berechnet man aus den Anfangswerten: <math>n = \frac {p_1 V_1}{R T_1}</math> = 1 bar * 20 m<sup>3</sup> / 8.31 J/K/mol / 300 K = 802 mol. |
||
#Im zweiten Teilprozess, der isochoren Auskühlung, beträgt die Änderung der inneren Energie <math>\Delta W=n\hat c_V(T_3-T_2)</math> = -3.7 MJ. Die zugehörige Entropieänderung ist gleich <math>\Delta S=n\hat c_V\ln\left(\frac{T_3}{T_2}\right)</math> = -9.2 kJ/K. |
#Im zweiten Teilprozess, der isochoren Auskühlung, beträgt die Änderung der inneren Energie <math>\Delta W=n\hat c_V(T_3-T_2)</math> = -3.7 MJ. Die zugehörige Entropieänderung ist gleich <math>\Delta S=n\hat c_V\ln\left(\frac{T_3}{T_2}\right)</math> = -9.2 kJ/K. |
||
Version vom 13. April 2010, 12:30 Uhr
-
T-S-Diagramm
-
p-V-Diagramm
- Im T-S-Diagramm bilden die Isentropen vertikale Linien, die Isochoren verlaufen exponentiell in Funktion der Entropie oder logarithmisch mit der Temperatur. Im p-V-Diagramm schneiden die Isentropen die Isothermen unter einem spitzen Winkel, die Isochoren verlaufen vertikal.
- Am Ende des ersten Teilprozesses beträgt der Druck [math]p_2=p_1\left(\frac {V_1}{V_2}\right)^\kappa[/math] = 1 bar * (20 m3 / 5 m3)1.4 = 6.96 bar und die Temperatur ist gleich [math]T_2=T_1\frac{p_2V_2}{p_1 V_1}[/math] = 300 K * (6.96 bar * 5 m3)/(1 bar * 20 m3) = 522 K. Nach dem zweiten Teilprozess betragen das Volumen V3 = 5 m3, die Temperatur T3 = 300 K und der Druck p3 = p1 * V1 / V3 = 1 bar * 20 m3 / 5 m3 = 4 bar. Nach dem dritten Teilprozess beträgt der Druck nur noch [math]p_4 = p_3\left(\frac {V_3}{V_4}\right)^\kappa[/math] = 4 bar * (5 m3 / 20 m3)1.4 = 0.574 bar und die Temperatur misst [math]T_4 = T_3 \frac{p_4 V_4}{p_3 V_3}[/math] = 300 K * (0.574 bar * 20 m3)/(4 bar * 5 m3) = 172 K. Für die Berechnung dieser Werte geht man am besten vom Anfangszustand des isentropen Teilprozesses aus und verwendet dann die Isentropengleichung und die thermische Zustandsgleichung.
- Die Arbeit bei den isochoren Teilprozesse ist 0. Die Arbeit bei den isentropen Teilprozessen ist gleich der Änderung der inneren Energie. Diese hängt wiederum nur von der Temperatur ab [math]W_{tot}=W_{12}+W_{34}=n\hat c_V(T_2-T_1+T_4-T_3)=n\hat c_V(T_2+T_4-2T_1)[/math] = 802 mol * = 1.57 MJ. Die Stoffmenge berechnet man aus den Anfangswerten: [math]n = \frac {p_1 V_1}{R T_1}[/math] = 1 bar * 20 m3 / 8.31 J/K/mol / 300 K = 802 mol.
- Im zweiten Teilprozess, der isochoren Auskühlung, beträgt die Änderung der inneren Energie [math]\Delta W=n\hat c_V(T_3-T_2)[/math] = -3.7 MJ. Die zugehörige Entropieänderung ist gleich [math]\Delta S=n\hat c_V\ln\left(\frac{T_3}{T_2}\right)[/math] = -9.2 kJ/K.