Lösung zu Kreisprozess dreiteilig
-
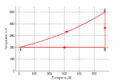
T-S-Diagramm
-
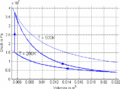
p-V-Diagramm
- Im T-S-Diagramm verläuft die isochore Zustandsänderung exponentiell, die isentrope vertikal und die isotherme horizontal. Im p-V-Diagramm steigt die Kurve zuerst vertikal nach oben, läuft dann auf der [math]pV^k=p_0V_0^k[/math] - Kurve nach rechts unten und auf einer Hyperbel wieder nach links oben. Im T-S-Diagramm entspricht die Fläche unter der Kurve eines Teilprozesses der Wärme. Im p-V-Diagramm ergibt die entsprechende Fläche die (negativ genommene) Arbeit.
- Die innere Energie eines idealen Gases hängt nur von der Temperatur ab. Im ersten Teilprozess (isochor) nimmt die innere Energie um [math]\Delta W_1 = n \hat c_V \Delta T = n \frac 3 2 R\Delta T[/math] = 50 mol * 1.5 * 8.31 J/K/mol * 300 K = 187 kJ zu. Um genau diesen Betrag nimmt die innere Energie im zweiten, isentropen Prozess wieder ab, weil das Gas wieder auf die Anfangstemperatur zurückgebracht wird: ΔW2 = - 187 kJ. Im 3. Teilprozess ändert sich die innere Energie nicht mehr, weil die Temperatur konstant bleibt: ΔW3 = 0.
- Im ersten Teilprozess nimmt die Entropie um [math]\Delta S_1=n\hat c_V\ln{\frac{T_2}{T_1}}=n\frac 3 2 R\ln{\frac{T_2}{T_1}}[/math] = 50 mol * 1.5 * 8.31 J/K/mol * ln(500 K / 200 K) = 571 J/K zu. Im zweiten, isentropen Teilprozess bleibt die Entropie konstant. Und im dritten, isothermen Teilprozess, der das Gas wieder auf die Anfangstemperatur zurückbringt, nimmt sie um denselben Betrag wieder ab wie im ersten Teilprozess: ΔS3 = - 571 J/K.
- Die Arbeit, also die mechanisch abgegebene Energie, entspricht der Fläche, die vom Prozess im p-V-Diagramm eingeschlossen wird. Während des ersten Teilprozesses ist die Arbeit 0, weil sich das Volumen nicht ändert: Wmech,1 = 0. Im zweiten, isentropen Teilprozess ist die mechanisch abgeführte Energie gleich der Änderung der inneren Energie, weil keine thermische Energie ausgetauscht wird: Wmech,2 = ΔW2 = - 187 kJ. Im dritten Teilprozess ändert sich die innere Energie nicht ΔW3 = Wmech,3 + Wtherm,3 = 0. Deshalb ist die thermisch abgegebene Energie gleich der mechanisch zugeführten: Wmech,3 = - Wtherm,3. Die thermisch abgeführte Energie können wir mit der abgeführten Entropie und der konstanten Temperatur berechnen: Wmech,3 = - Wtherm,3 = - (- 571 J/K) * 200 K = 114 kJ. Die Kompressionsarbeit beträgt demnach 114 kJ. Durch Addition aller Arbeiten erhält man für den ganzen Zyklus eine mechanisch abgeführte Energie von Wmech,Prozess = Wmech,1 + Wmech,2 + Wmech,3 = - 187 kJ + 0 + 114 kJ = -73 kJ.