Ideales Gas
Modell
Das Modell des idealen Gases beschreibt den Zustand von stark verdünnten Stoffen; die Wechselwirkung zwischen den Teilchen dieses Stoffes sollte vernachlässigbar klein sein. Das Modell des idealen Gases ist auf gasförmige und gelöste Stoffe anwendbar.
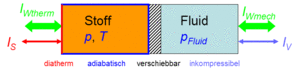
Der Zustand des idealen Gases kann auf zwei Arten verändert werden, durch heizen und kühlen oder durch komprimieren und entspannen. Um diese Prozesse kontrolliert ablaufen zu lassen, gehen wir von folgender Anordnung aus. Das Gas befinde sich in einem Zylinder, der mit einem Kolben verschlossen ist. Der Zylinderboden sei ideal wärmedurchlässig (diatherm), besitze aber selber keine Wärmekapazität. Die Zylinderwände und der Koblen sind absolut wärmeisoliert (adiabatisch). Der reibunsfrei verschiebbare Kolben schliesst das Gas hermetisch gegen eine Flüssigkeit ab, welche für den Druckaufbau verantwortlich ist. Bei Lösungen ist die Flüssigkeit gleichzeitig Lösungsmittel und der Kolben für das Lösungsmittel durchlässig, für den gelösten Stoff dagegen nicht. Einen dermassen selektiv durchlässigen Kolben nennt man semipermeabel.
Das Systeme Gas besitzt einen direkten thermischen und einen indirekten hydraulischen Kontakt zur Umgebung. Es kann somit mit der Umgebung Energie in Form von Wärme und Arbeit austauschen.
Bilanzen und Prozesse
Das ideal Gas besitzt zusammen mit der hydraulischen Erweiterung zwei Verbindungen zur Aussenwelt, eine thermische und eine hydraulische. Weil das Gas homogen ist und die Verbindungen ideal, wird innerhalb des Systems keine Entropie produziert. Folglich kann die Entropiebilanz und die Volumbenbilanz in einfachster Form hingeschrieben werden
[math]\begin{matrix} I_S &=& \dot S \\ I_V &=& \dot V_{Fluid} = -\dot V \end{matrix}[/math]