Ideales Gas: Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) |
Admin (Diskussion | Beiträge) |
||
| Zeile 41: | Zeile 41: | ||
==konstitutive Gleichungen== |
==konstitutive Gleichungen== |
||
Beim idealen Gas koppeln zwei Bilanzgleichungen über die beiden zugehörigen [[Potenzial|Potenziale]]. Im Gegensatz zum Massenpunt als dreifacher, aber entkoppelter Impulsspeicher und anders als beim [[starrer Körper|starren Körper]] als dreifacher Drehimpulsspeicher, |
Beim idealen Gas koppeln zwei Bilanzgleichungen über die beiden zugehörigen [[Potenzial|Potenziale]]. Im Gegensatz zum Massenpunt als dreifacher, aber entkoppelter Impulsspeicher und anders als beim [[starrer Körper|starren Körper]] als dreifacher Drehimpulsspeicher, ist die Struktur dieser beiden Speichergesetze nicht ganz einfach zu durchschauen. |
||
Das erste Speichergesetz, die universelle Gasgleichung oder die thermische Zustandsgleichung des idealen Gases, verknüpft die drei |
Das erste Speichergesetz, die universelle Gasgleichung oder die thermische Zustandsgleichung des idealen Gases, verknüpft die drei direkt messbaren Grössen Druck, Volumen und Temperatur miteinander |
||
<math>pV= nRT=mR_sT</math> |
<math>pV= nRT=mR_sT</math> |
||
| Zeile 52: | Zeile 52: | ||
<math>S = S_0 + n (R ln \frac {V}{V_0} + \hat c_V ln \frac {T}{T_0}) = S_0 + m (R_s ln \frac {V}{V_0} + c_V ln \frac {T}{T_0})</math> |
<math>S = S_0 + n (R ln \frac {V}{V_0} + \hat c_V ln \frac {T}{T_0}) = S_0 + m (R_s ln \frac {V}{V_0} + c_V ln \frac {T}{T_0})</math> |
||
Die molare oder spezifische Energiekapazität (''c^<sub>V</sub>'' oder ''c<sub>V</sub>'', auch molare oder spezifische Wärmekapazität bei konstantem Volumen genannt) ist für einatomige Gase gleich 3 ''R'' / 2 bzw. 3 ''R<sub>s</sub> / 2. |
|||
Mit Hilfe der universellen Gasgleichung kann das Speichergesetz für die Entropie umgeformt werden in |
|||
<math>S = S_0 + n (R ln \frac {p_0}{p} + \hat c_p ln \frac {T}{T_0}) = S_0 + m (R_s ln \frac {p_0}{p} + c_p ln \frac {T}{T_0})</math> |
|||
vobei c^<sub>p</sub>'' oder ''c<sub>p</sub>, die molare bzw. spezifische Enthalpiekapazität (auch moalre bzw. spezifische Wärmekapazität bei konstantem Druck genannt) um eine Gaskonstante grösser ist als die molare bzw. spezifische Wärmekapazität. |
|||
Die beiden konstitutiven Gleichungen nehmen bei den vier grundlegenden Prozessen die folgende Form an (um einen zeitabhängigen Prozess zu beschreiben, müssen die Gleichungen unter Berücksichtigung der Nebenbedingungen nach der Zeit abgeleitet werden) |
|||
{| |
|||
!width = "100"|Prozess |
|||
!width = "150"|Gasgleichung |
|||
!width = "150"|Entropiegesetz |
|||
!width = "150"|Bemerkung |
|||
|- |
|||
|isochor |
|||
|<math>V \dot p = n R \dot T</math> |
|||
|<math>\dot S = n \hat c_V \frac {\dot T}{T}</math> |
|||
|<math>\dot V = 0</math> |
|||
|- |
|||
|isobar |
|||
|<math>p \dot V = n R \dot T</math> |
|||
|<math>\dot S = n \hat c_p \frac {\dot T}{T}</math> |
|||
|<math>\dot p = 0</math> |
|||
|- |
|||
|isentrop |
|||
|<math>R \frac {\dot V}{V}\hat + c_V \frac {\dot T}{T} = 0</math> |
|||
|<math>\dot S = 0</math> |
|||
|erste Geleichung folgt aus Entropiegesetz |
|||
|- |
|||
|isotherm |
|||
|<math>\dot p V + \dot V p = 0</math> |
|||
|<math>\dot S = n R \frac {\dot V}{V}</math> |
|||
|<math>\dot T = 0</math> |
|||
|} |
|||
==Energiebilanz== |
==Energiebilanz== |
||
Version vom 21. August 2006, 19:30 Uhr
Modell
Das Modell des idealen Gases beschreibt den Zustand von stark verdünnten Stoffen, wobei die Wechselwirkung zwischen den Teilchen dieses Stoffes vernachlässigbar klein sein sollte. Dieses Modell ist auf gasförmige und gelöste Stoffe anwendbar.
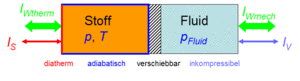
Der Zustand des idealen Gases kann auf zwei Arten verändert werden, durch heizen und kühlen oder durch komprimieren und entspannen. Um diese Prozesse kontrolliert ablaufen zu lassen, gehen wir von folgender Anordnung aus. Das Gas befinde sich in einem Zylinder, der mit einem Kolben verschlossen ist. Der Zylinderboden sei ideal wärmedurchlässig (diatherm), besitze aber selber keine Wärmekapazität. Die Zylinderwände und der Koblen sind absolut wärmeisoliert (adiabatisch). Der reibunsfrei verschiebbare Kolben schliesst das Gas hermetisch gegen eine inkompressible Flüssigkeit ab, welche für den Druckaufbau verantwortlich ist. Bei Lösungen ist die Flüssigkeit gleichzeitig Lösungsmittel und der Kolben für das Lösungsmittel durchlässig, für den gelösten Stoff dagegen nicht. Einen dermassen selektiv durchlässigen Kolben nennt man semipermeabel.
Das Systeme Gas besitzt eine direkte thermische und einen indirekten hydraulische Verbindung zur Umgebung. Es kann deshalb mit der Umgebung Energie in Form von Wärme und Arbeit austauschen.
Bilanzen und Prozesse
Das ideal Gas kann über die zwei Verbindungen (Portale oder Konnektoren) Entropie und Volumen mit der Umgebung austauschen. Weil das Gas homogen ist und die Verbindungen ideal sind, wird innerhalb des Systems keine Entropie produziert. Folglich kann die Entropiebilanz und die Volumenbilanz in einfachster Form hingeschrieben werden
[math]\begin{matrix} I_S &=& \dot S \\ I_V &=& \dot V_{Fluid} = -\dot V \end{matrix}[/math]
Das ideale Gas kann vier einfach zu realisierende Prozesse durchlaufen. In zwei Prozessen ist je ein Portal geschlossen, in den zwei andern ist das Portal hemmungslos mit der Umwelt verbunden, so dass innen und aussen der gleiche Druck bzw. die gleiche Temperatur herrscht.
| Prozess | Beschreibung | thermisches Portal | hydraulisches Portal |
|---|---|---|---|
| isochor | V =konst | aktiv | geschlossen |
| isobar | p =konst | aktiv | Kurzschluss |
| isentrop | S =konst | geschlossen | aktiv |
| isotherm | T =konst | Kurzschluss | aktiv |
konstitutive Gleichungen
Beim idealen Gas koppeln zwei Bilanzgleichungen über die beiden zugehörigen Potenziale. Im Gegensatz zum Massenpunt als dreifacher, aber entkoppelter Impulsspeicher und anders als beim starren Körper als dreifacher Drehimpulsspeicher, ist die Struktur dieser beiden Speichergesetze nicht ganz einfach zu durchschauen.
Das erste Speichergesetz, die universelle Gasgleichung oder die thermische Zustandsgleichung des idealen Gases, verknüpft die drei direkt messbaren Grössen Druck, Volumen und Temperatur miteinander
[math]pV= nRT=mR_sT[/math]
Die erste Form basiert auf der Stoffmenge als natürliches Mass für die Menge eines Stoffes, die zweite nimmt die Masse als Hilfsgrösse, um die Menge des Soffes zu quantifizieren. R steht für die universelle Gaskonstante und R_s für die spezifische Gaskonstante, die für jeden Stoff einen andern Wert annimmt.
Das zweit Speichergesetz beschreibt die Entropie in Funktion des Volumens und der Temperatur
[math]S = S_0 + n (R ln \frac {V}{V_0} + \hat c_V ln \frac {T}{T_0}) = S_0 + m (R_s ln \frac {V}{V_0} + c_V ln \frac {T}{T_0})[/math]
Die molare oder spezifische Energiekapazität (c^V oder cV, auch molare oder spezifische Wärmekapazität bei konstantem Volumen genannt) ist für einatomige Gase gleich 3 R / 2 bzw. 3 Rs / 2.
Mit Hilfe der universellen Gasgleichung kann das Speichergesetz für die Entropie umgeformt werden in
[math]S = S_0 + n (R ln \frac {p_0}{p} + \hat c_p ln \frac {T}{T_0}) = S_0 + m (R_s ln \frac {p_0}{p} + c_p ln \frac {T}{T_0})[/math]
vobei c^p oder cp, die molare bzw. spezifische Enthalpiekapazität (auch moalre bzw. spezifische Wärmekapazität bei konstantem Druck genannt) um eine Gaskonstante grösser ist als die molare bzw. spezifische Wärmekapazität.
Die beiden konstitutiven Gleichungen nehmen bei den vier grundlegenden Prozessen die folgende Form an (um einen zeitabhängigen Prozess zu beschreiben, müssen die Gleichungen unter Berücksichtigung der Nebenbedingungen nach der Zeit abgeleitet werden)
| Prozess | Gasgleichung | Entropiegesetz | Bemerkung |
|---|---|---|---|
| isochor | [math]V \dot p = n R \dot T[/math] | [math]\dot S = n \hat c_V \frac {\dot T}{T}[/math] | [math]\dot V = 0[/math] |
| isobar | [math]p \dot V = n R \dot T[/math] | [math]\dot S = n \hat c_p \frac {\dot T}{T}[/math] | [math]\dot p = 0[/math] |
| isentrop | [math]R \frac {\dot V}{V}\hat + c_V \frac {\dot T}{T} = 0[/math] | [math]\dot S = 0[/math] | erste Geleichung folgt aus Entropiegesetz |
| isotherm | [math]\dot p V + \dot V p = 0[/math] | [math]\dot S = n R \frac {\dot V}{V}[/math] | [math]\dot T = 0[/math] |