Kreisprozesse: Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) |
Admin (Diskussion | Beiträge) |
||
| Zeile 200: | Zeile 200: | ||
Der Stirling-Zyklus ist durch die Temperatur der beiden Wärmebäder, die beiden Grenzvolumen sowie den Isentropenexponenten des Arbeitsgases (''κ'') festgelegt. |
Der Stirling-Zyklus ist durch die Temperatur der beiden Wärmebäder, die beiden Grenzvolumen sowie den Isentropenexponenten des Arbeitsgases (''κ'') festgelegt. |
||
Zur Simulation im [[Carnotor]] teilt man die gesamte Simulationszeit in vier gleich grosse Abschnitte ein. Aus den beiden Volumen und diesem Zeitabschnitt ergeben sich die Volumenströme der isothermen Prozesse. Zudem berechnet man mit Hilfe der oben aufgeführten Formeln die Entropieänderung in den beiden isochoren Prozessen. Daraus ergeben sie die zugehörigen Entropieströme. |
|||
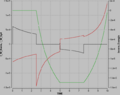
Die erste Graphik zeigen den thermischen (schwarz) und den mechanischen (rot) Energiestrom sowie die Änderung der inneren Energie. In den beiden andern Bildern sind die grundlegenden statischen Diagramme dargestellt. Die Fläche unter dem Temperatur-Entropie-Diagramm entspricht der zugeführten Wärmeenergie, die Fläche unter dem Druck-Volumen-Diagramm der abeführten Arbeit. Die beiden eingeschlossenen Flächen sind energetisch äquivalent. |
|||
<gallery> |
<gallery> |
||
Version vom 28. Januar 2008, 06:08 Uhr
Reale Prozesse, wie sie in Wärmepumpen und Wärmekraftmaschinen ablaufen, lassen sich durch Kreisprozesse näherungsweise erklären; ein Kreisprozess bildet eine Idealisierung des realen Vorganges. Aus dem Wort Kreisprozess geht hervor, dass ein Stoff (meist ein Gas) zyklisch die gleichen Zustände durchläuft. Im Kreisprozess tauscht der Stoff reversibel Entropie mit der Umgebung aus.
In dieser Vorlesung werden drei Kreisprozess behandelt. Der Carnot-Prozess ist nur vom historischen Interesse. Anhand dieses Prozesses hat Rudolf Clausius die Entropie als Zustandsgrösse hergeleitet. Viele Physikkurse folgen bei der Einführung der Entropie immer noch den Ideen von Clausius und verschleiern damit, dass die Entropie eine Primärgrösse ist, die in der Natur existiert und die man nicht aus fundamentaleren Grössen herleiten muss. Der Stirling-Prozess wird in dem von Robert Stirling erfunden Motor näherungsweise realisiert. Von zentraler Bedeutung für die Technik ist der Joule-Prozess, weil das Gas in Gastubinen und Strahltriebwerken in guter Näherung diesen Kreisprozess durchläuft.
Lernziele
Sie lernen in dieser Vorlesung
Basisprozesse
In der letzten Vorlesung haben Sie gelernt, wie man mit Hilfe eines systemdynamischen Modells, des Carnotors, die vier Basisprozess simuliert. Weil das Gas bei diesen Prozessen lauter Gleichgewichtszustände durchläuft, genügt eine statische Analyse. Das dazu notwendige Wissen wird nachfolgend nochmals vertieft.
isochor
Beim isochoren Heizen oder Kühlen wird Entropie bei konstant gehaltenem Volumen zu- oder abgeführt. Der hydraulische Zugang muss beim Carnotor geschlossen und der thermische aktiviert sein. Isobare Prozess werden durch folgende Beziehungen beschrieben
| Prozess | thermisch | kalorisch | entropisch |
|---|---|---|---|
| isochor | [math]\frac pT=\frac{nR}{V}[/math] = konst. | [math]\Delta W=n\hat c_V\Delta T[/math] | [math]\Delta S=n\hat c_V\ln{\frac{T_2}{T_1}}[/math] |
Der Druck steigt proportional zu absoluten Temperatur, die innere Energie mit der Temperaturdifferenz und die Entropie mit dem Logarithmus der Temperaturverhältnisse. Die molare Energiekapazität (Wärmekapazität bei konstantem Volumen) ist gleich der Zahl der Freiheitsgrade der Teilchen mal die halbe universelle Gaskonstante
- [math]\hat c_V=\frac f2 R[/math].
isobar
Beim isobaren Heizen oder Kühlen wird Entropie bei konstant gehaltenem Druck zu- oder abgeführt. Der hydraulische Zugang muss beim Carnotor auf Freilauf geschaltet und der thermische aktiviert sein. Die Stärke des zufliessenden Wärmestromes ist gleich der Änderungsrate der Enthalpie
- [math]I_{W_{therm}}=\dot H=n\hat c_p\dot T=\dot W+p\dot V=n\hat c_V\dot T+nR\dot T[/math]
In der letzten Umformung ist die thermische Zustandsgleichung des idealen Gases verwendet worden. Daraus folgt für die molare Enthalpiekapazität (Wärmekapazität bei konstantem Druck) des idealen Gases
- [math]\hat c_p=\hat c_V+R[/math]
Die molare Enthalpiekapazität (Wärmekapazität bei konstantem Druck) näherungsweise idealer Gase ist gleich der Zahl der Freiheitsgrade plus zwei mal die halbe universelle Gaskonstante
- [math]\hat c_p=\frac{f+2}{2}R[/math]
Das isobare Heizen oder Kühlen von idealem Gas wird durch folgende Gleichungen beschrieben
| Prozess | thermisch | kalorisch | entropisch |
|---|---|---|---|
| isobar | [math]\frac VT=\frac{nR}p[/math] = konst. | [math]\Delta H=n\hat c_p\Delta T[/math] | [math]\Delta S=n\hat c_p\ln{\frac{T_2}{T_1}}[/math] |
Das Volumen vergrössert sich proportional zur absoluten Temperatur, die Enthalpie wächst mit der Temperaturdifferenz und die Entropie mit dem Logarithmus der Temperaturverhältnisse.
isentrop
Beim isentropen Komprimieren oder Expandieren ändert sich die Entropie des Gases nicht. Der hydraulische Zugang des Carnotor ist aktiviert und der thermische geschlossen. Aus der Beschreibung der Entropie in Funktion des Volumens und der Temperatur
- [math]\Delta S=n\left(\hat c_V\ln{\frac{T_2}{T_1}}+R\ln{\frac{V_2}{V_1}}\right)=0[/math]
folgt
- [math]\left(\frac{V_2}{V_1}\right)^R=\left(\frac{T_1}{T_2}\right)^{\hat c_V}[/math]
Diese Gleichung wird meist mit Hilfe des Isentropenexponenten κ, dem Verhältnis von Enthalpie- zu Energiekapazität, beschrieben
- [math]\kappa=\frac{\hat c_p}{\hat c_V}=\frac{\hat c_V+R}{\hat c_V}=\frac{f+2}{f}[/math]
Der Isentropenexpoenent beträgt für Edelgase 3/2 und für Luft 1.4. Mit Hilfe der thermischen Zustandsgleichung des idealen Gases kann diese Beziehung auf die Zustandsgrössen Druck und Volumen bzw. Druck und Temperatur umgerechnet werden
| Prozess | thermisch | kalorisch | entropisch |
|---|---|---|---|
| isentrop | [math]\left(\frac{V_2}{V_1}\right)^{\kappa-1}=\frac{T_1}{T_2}[/math] [math]\left(\frac{V_2}{V_1}\right)^\kappa=\frac{p_1}{p_2}[/math] |
[math]\Delta W=n\hat c_V\Delta T[/math] | [math]\Delta S=0[/math] |
Hier erscheint die Wärmekapazität bei konstantem Volumen, obwohl bei diesem Prozess keine thermische Energie ausgetauscht wird und das Volumen nicht konstant bleibt. Die Bezeichnung Energiekapazität wäre deshalb die treffendere Bezeichnung. Die mittlere Form unter den thermischen Zustandsgleichungen für den isentropen Prozess hat eine gewisse Ähnlichkeit mit dem Boyleschen Gesetz [math]pV^\kappa=konst.[/math].
isotherm
Beim isothermen Komprimieren oder Expandieren wird unkontrolliert Entropie mit der Umgebung ausgetauscht. Der hydraulische Zugang des Carnotors ist aktiviert und der thermische auf Freilauf geschaltet. Die innere Energie bleibt infolge gleich bleibender Temperatur konstant. Deshalb ist die Summe aus thermischem und mechanischem Energiestrom gleich Null. Bei der isothermen Prozessführung wird also Arbeit vollständig in Wärme bzw. Wärme vollständig in Arbeit umgewandelt. Bildlich gesprochen wird bei der Kompression die mechanisch zugeführte Energie auf die abfliessende Entropie umgeladen. Bei der Expansion wird die mit der Entropie zugeführte Energie an einen mechanischen Träger (Impuls oder Volumen) abgegeben, wobei die Entropie im sich vergrössernden Volumen gespeichert bleibt.
Das isotherme Komprimieren oder Expandieren von idealem Gas wird durch folgende Gleichungen beschrieben
| Prozess | thermisch | kalorisch | entropisch |
|---|---|---|---|
| isotherm | [math]pV=nRT[/math] = konst. | [math]\Delta W=0[/math] | [math]\Delta S=nR\ln{\frac{V_2}{V_1}}[/math] |
Das Produkt aus Volumen und absolutem Druck bleibt konstant. Die Arbeit lässt sich, wie in der letzten Vorlesung gezeigt, durch direkte Integration der Druck-Volumen-Beziehung berechnen, oder über die Wärme, die bei konstanter Temperatur gleich ausgetauschte Entropie mal diese Temperatur ist
- [math]W_{mech}=-W_{therm}=-TS_{aus}=-T\Delta S=nRT\ln{\frac{V_1}{V_2}}[/math]
Carnot-Zyklus
Der Carnot-Zyklus wurde erstmals 1824 von Sadi Carnot in der berühmt gewordenen Publikation über die bewegende Kraft des Feuers (Réflexions sur la puissance motrice du feu) veröffentlicht. Dabei vertrat Carnot die Hypothese, dass die Wärme (chaleur) wie das fallende Wasser eine bewegende Kraft entfaltet, sobald sie über ein Temperaturgefälle fliesst. Identifiziert man die Wärme mit der Entropie und die bewegende Kraft mit der Energie, hat Carnot eine äusserst tragfähiges Modell thermischer Prozesse entwickelt.
Beim Carnot-Zyklus wird Wärme über eine isotherme Expansion eines Arbeitsgases aus einem heissen Wärmebad entnommen (hier ist mit Wärme - entsprechend der Vorstellung von Carnot - die Entropie gemeint). Danach wird das Gas isentrop entspannt, bis es die Temperatur eines zweiten, kalten Wärmebades erreicht hat. An dieses Bad gibt das Gas die aufgenommene Wärme bei konstant gehaltener Temperatur wieder ab. Danach wird das Arbeitsgas ohne weiteren Wärmeaustausch auf die ursprünglich Temperatur gedrückt.
Nummeriert man die "Eckpunkte" des Carnot-Zyklus mit 1, 2, 3, 4, ergibt sich die folgende Beschreibung
| Prozess | thermische Beschreibung | Entropie | Energie |
|---|---|---|---|
| isotherme Expansion 1 nach 2 | [math]pV=nRT_{12}=konst[/math] | [math]\Delta S=nR\ln{\frac{V_2}{V_1}}[/math] | Wärme = [math]nRT_{12}\ln{\frac{V_2}{V_1}}[/math] = -Arbeit |
| isentrope Expansion 2 nach 3 | [math]\left(\frac{V_3}{V_2}\right)^{\kappa-1}=\frac{T_{12}}{T_{34}}[/math] | [math]\Delta S=0[/math] | Arbeit = [math]n\hat c_V(T_{34}-T_{12})[/math] |
| isotherme Kompression 3 nach 4 | [math]pV=nRT_{34}=konst[/math] | [math]\Delta S=nR\ln{\frac{V_4}{V_3}}[/math] | Arbeit = [math]nRT_{34}\ln{\frac{V_3}{V_4}}[/math] = -Wärme |
| isentrope Kompression 4 nach 1 | [math]\left(\frac{V_1}{V_4}\right)^{\kappa-1}=\frac{T_{34}}{T_{12}}[/math] | [math]\Delta S=0[/math] | Arbeit = [math]n\hat c_V(T_{12}-T_{34})[/math] |
Der hydraulische Port des Carnotors ist beim Carnot-Zyklus immer aktiv. Der thermische Port wird entweder auf geschlossen (isentrop) oder auf Freilauf geschaltet (isotherm). Weil die bei hoher Temperatur zugeführte Entropie der bei tiefer wieder abgeführten entspricht, folgt für die Volumen in den vier Eckpunkten
- [math]\frac {V_2}{V_1}=\frac {V_3}{V_4}[/math]
Der Carnot-Zyklus ist durch die Temperatur der beiden Wärmebäder, das minimale und das maximale Volumen sowie den Isentropenexponenten des Arbeitsgases (κ) festgelegt.
Zur Simulation im Carnotor teilt man die gesamte Simulationszeit in vier gleich grosse Abschnitte ein. Zudem berechnet man mit Hilfe der oben aufgeführten Formeln aus den gewählten Werten (Temperaturen der Wärmebäder, grösstes und kleinstes Volumen) die beiden andern Volumen. Daraus ergeben sie die Volumenströme für die vier Teilprozesse. Der thermische Anschluss ist während diesen vier Zeitspannen entweder mit einem der beiden Wärmebäder zu verbinden oder zu schliessen.
Die erste Graphik zeigen den thermischen (schwarz) und den mechanischen (rot) Energiestrom sowie die Änderung der inneren Energie. In den beiden andern Bildern sind die grundlegenden statischen Diagramme dargestellt. Die Fläche unter dem Temperatur-Entropie-Diagramm entspricht der zugeführten Wärmeenergie, die Fläche unter dem Druck-Volumen-Diagramm der abeführten Arbeit.
-
Energie
-
T-S-Diagramm
-
p-V-Diagramm
Stirling-Zyklus
Der Stirling-Zyklus unterscheidet sich vom Carnot-Zyklus durch isochore statt isentrope Prozesse. In beiden Zyklen dienen diese Prozesse der Anpassung der Temperatur des Arbeitsgases an die der Wärmebäder. Die beiden eigentlichen Arbeitstakte, Entropie bei hoher Temperatur aufnehmen und bei tiefer wieder abgeben, sind identisch. Der Stirling-Zyklus wird in den Stirlingmotoren näherungsweise realisiert.
Nummeriert man die "Eckpunkte" des Stirling-Zyklus mit 1, 2, 3, 4, ergibt sich die folgende Beschreibung
| Prozess | thermische Beschreibung | Entropie | Energie |
|---|---|---|---|
| isotherme Expansion 1 nach 2 | [math]pV=nRT_{12}=konst[/math] | [math]\Delta S=nR\ln{\frac{V_2}{V_1}}[/math] | Wärme = [math]nRT_{12}\ln{\frac{V_2}{V_1}}[/math] = -Arbeit |
| isochore Abkühlung 2 nach 3 | [math]\frac{p}{T}=\frac{nR}{V_{23}}=konst.[/math] | [math]\Delta S=n\hat c_V\ln{\frac{T_{34}}{T_{12}}}[/math] | Wärme = [math]n\hat c_V(T_{34}-T_{12})[/math] |
| isotherme Kompression 3 nach 4 | [math]pV=nRT_{34}=konst[/math] | [math]\Delta S=nR\ln{\frac{V_4}{V_3}}[/math] | Arbeit = [math]nRT_{34}\ln{\frac{V_3}{V_4}}[/math] = -Wärme |
| isochore Erwärmung 4 nach 1 | [math]\frac{p}{T}=\frac{nR}{V_{41}}=konst.[/math] | [math]\Delta S=n\hat c_V\ln{\frac{T_{12}}{T_{34}}}[/math] | Wärme = [math]n\hat c_V(T_{12}-T_{34})[/math] |
Der hydraulische Port des Carnotors ist beim Stirling-Zyklus nur noch bei den beiden isothermen Prozessen aktiv. In den beiden isochoren Prozessen ist er geschlossen. Der thermische Port ist bei den beiden isothermen Prozessen wie beim Carnot-Zyklus auf Freilauf geschaltet (isotherm). In den beiden isochoren Prozessen ist der thermische Port aktiv.
Der Unterschied zwischen dem Carnot- und dem Stirling-Zyklus liegt in den beiden "blinden" Prozessen, die nur der Temperaturveränderung zwischen den beiden Hauptprozessen (Entropie bei hoher Temperatur aufnehmen und bei tiefer wieder abgeben) dienen. Im Carnot-Zyklus wird die durch die Änderung der inneren Energie bedingte, abzugebende oder aufzunehmende Energie mechanisch zwischengespeichert. Im Stirling-Zyklus wird diese Energie zusammen mit der Entropie bei unterschiedlicher Temperatur abgegeben und wieder aufgenommen. Würde die Wärme beim Aufheizen des Arbeitsgases vom warmen Bad zugeführt und beim Abkühlen an das kalte abgegeben, käme dies einer nutzlosen Wärmeübertragung vom heissen zum kalten Bad gleich. Die dabei produzierte Entropie wäre dann gleich der an das kalte Bad abgegebene Entropie minus die vom warmen aufgenommenen (bei konstant gehaltener Temperatur ist die ausgetauschte Entropie gleich der Wärmeenergie durch die absolute Temperatur)
- [math]S_{prod}=n\hat c_V(T_{12}-T_{34})\left(\frac{1}{T_{34}}-\frac{1}{T_{12}}\right)[/math]
Diese Entropie wird beim hinunter Fliessen der Entropie vom warmen Bad ans kältere Arbeitsgas und von diesem ans kalte Bad produziert (jedes unkontrollierte hinunter Plätschern einer Primärgrösse erzeugt Entropie). Um dies zu Verhindern, arbeiten Stirling-Motoren mit einem Zwischenspeicher, Regenerator genannt. Dort wird die Entropie beim isochoren Abkühlen Zwischengespechert, um dann beim isochoren Heizen wird abgeholt zu werden. Der Regenerator bildet dabei ein Abfolge von kleinen Wärmespeichern unterschiedlicher Temperaturen. Im Idealfall wird die Entropie exakt bei der Temperatur zwischengespeichert, bei der sie das Arbeitsgas abgibt.
Der Stirling-Zyklus ist durch die Temperatur der beiden Wärmebäder, die beiden Grenzvolumen sowie den Isentropenexponenten des Arbeitsgases (κ) festgelegt.
Zur Simulation im Carnotor teilt man die gesamte Simulationszeit in vier gleich grosse Abschnitte ein. Aus den beiden Volumen und diesem Zeitabschnitt ergeben sich die Volumenströme der isothermen Prozesse. Zudem berechnet man mit Hilfe der oben aufgeführten Formeln die Entropieänderung in den beiden isochoren Prozessen. Daraus ergeben sie die zugehörigen Entropieströme.
Die erste Graphik zeigen den thermischen (schwarz) und den mechanischen (rot) Energiestrom sowie die Änderung der inneren Energie. In den beiden andern Bildern sind die grundlegenden statischen Diagramme dargestellt. Die Fläche unter dem Temperatur-Entropie-Diagramm entspricht der zugeführten Wärmeenergie, die Fläche unter dem Druck-Volumen-Diagramm der abeführten Arbeit. Die beiden eingeschlossenen Flächen sind energetisch äquivalent.
-
Energie
-
T-S-Diagramm
-
p-V-Diagramm