Lösung zu Kreisprozess Stirling: Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) (Die Seite wurde neu angelegt: #Die beiden Isothermen verlaufen im ''T-S-''Diagramm horizontal und im ''p-V-''Diagramm auf Hyperbeln. Die Isochoren bilden im ''T-S-''Diagramm eine Schar von Exponenti...) |
|||
| (12 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| + | <gallery> |
||
| ⚫ | #Die |
||
| + | Bild:Kreisprozess Stirling T-S-Diagramm.gif|''T-S-''Diagramm |
||
| − | |||
| + | Bild:Kreisprozess Stirling p-V-Diagramm.gif|''p-V-''Diagramm |
||
| + | </gallery> |
||
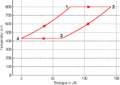
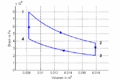
| ⚫ | #Die Isothermen verlaufen im ''T-S-''Diagramm horizontal, im ''p-V-''Diagramm bilden sie Hyperbeln. Die Isochoren ergeben im ''T-S-''Diagramm eine Schar von Exponentialfunktionen, im ''p-V-''Diagramm verlaufen sie vertikal. Im Stirling-Zyklus wird in den isothermen Prozessen Entropie von einem heissen Bad aufgenommen bzw. an ein kälteres abgegeben. Dazwischen muss die Temperatur gesenkt bzw. angehoben werden. Die beim Abkühlen frei zusetzende Entropie muss für das nachfolgende Heizen reversibel zwischengelagert werden. |
||
| + | #Das universelle Gasgesetz (thermische Zustandsgleichung) liefert bei bekanntem Druck und gegebener Temperatur das Volumen: <math>V_1=\frac{nRT_1}{p_1}</math> = 10 mol * 8.31 J/K/mol * 800 K / 80 bar = 0.00831 m<sup>3</sup> und <math>V_3 = \frac{nRT_3}{p_3}</math> = 10 mol * 8.31 J/K/mol * 430 K / 20 bar = 0.0179 m<sup>3</sup> (40 g Helium sind 10 mol, n = m / m<sub>mol</sub> = 40 g / 4 g = 10 mol). |
||
| + | #Die bei der isothermen Expansion aufgenommene Entropie beträgt <math> S_{12} = \Delta S_{12} = n R \ln{\frac{V_2}{V_1}}</math> = 10 mol * 8.31 J/K/mol * ln(0.0179 m<sup>3</sup> / 0.00831 m<sup>3</sup>) = 63.8 J/K. Die Entopieänderung des anderen isothermen Schrittes ist entgegengesetzt gleich: <math>S_{34} = \Delta S_{34} = n R \ln{\frac{V_4}{V_3}}</math> = 10 mol * 8.31 J/K/mol * ln(0.00831 m<sup>3</sup> / 0.0179 m<sup>3</sup>) = - 63.8 J/K (Logarithmus des reziproken Volumenverhältnis). |
||
| + | #Die beim isochoren Aufheizen aufzunehmende Entropie S<sub>41</sub> ist gleich der Entropieänderung <math>\Delta S_{41} = - \Delta S_{23} = n \frac{3}{2} R \ln{\frac{T_{1}}{T_{4}}}</math> = 10 mol * 1.5 * 8.31 J/K/mol * ln(800 K / 430 K) = 77.4 J/K. |
||
| + | #In reversibel geführten Kreisprozessen entspricht die Nettoarbeit der durch den Kreisprozess ausgeschnittenen Fläche im ''p-V-''Diagramm. Diese Energie wird von der Entropie beim Durchlaufen des Stirling-Zyklus freigesetzt. Im T-S-Diagramm entspricht sie ebenfalls der vom Prozess eingeschlossenen Fläche. In den beiden isochoren Schritten ist die Arbeit 0 und die Fläche unter der T-S-Kurve für diese beiden Schritte entspricht deshalb der Änderung der inneren Energie. Weil die Änderung der inneren Energie nur von den beiden entgegengesetzt gleichen Temperaturänderungen abhängig ist, sind die Flächen unter der T-S-Kurve für die beiden isochoren Schritte ebenfalls entgegengesetzt gleich und kompensieren sich. Für die im T-S-Diagramm eingeschlossene Fläche müssen wir deshalb nur die Flächen unter den horizontalen Schritten berücksichtigen. Diese entsprechen der Energie, welche die Entropie ΔS<sub>12</sub> bei der Temperatur T<sub>1</sub> aufnimmt und bei T<sub>3</sub> wieder abgibt (ΔS<sub>34</sub> = - ΔS<sub>12</sub>): <math>W_{frei}=\Delta S_{12}(T_{12}-T_{34})</math> = 63.8 J/K * (800 K - 430 K) = 23.6 kJ. |
||
'''[[Kreisprozess Stirling|Aufgabe]]''' |
'''[[Kreisprozess Stirling|Aufgabe]]''' |
||
Aktuelle Version vom 15. April 2010, 14:40 Uhr
- Die Isothermen verlaufen im T-S-Diagramm horizontal, im p-V-Diagramm bilden sie Hyperbeln. Die Isochoren ergeben im T-S-Diagramm eine Schar von Exponentialfunktionen, im p-V-Diagramm verlaufen sie vertikal. Im Stirling-Zyklus wird in den isothermen Prozessen Entropie von einem heissen Bad aufgenommen bzw. an ein kälteres abgegeben. Dazwischen muss die Temperatur gesenkt bzw. angehoben werden. Die beim Abkühlen frei zusetzende Entropie muss für das nachfolgende Heizen reversibel zwischengelagert werden.
- Das universelle Gasgesetz (thermische Zustandsgleichung) liefert bei bekanntem Druck und gegebener Temperatur das Volumen: [math]V_1=\frac{nRT_1}{p_1}[/math] = 10 mol * 8.31 J/K/mol * 800 K / 80 bar = 0.00831 m3 und [math]V_3 = \frac{nRT_3}{p_3}[/math] = 10 mol * 8.31 J/K/mol * 430 K / 20 bar = 0.0179 m3 (40 g Helium sind 10 mol, n = m / mmol = 40 g / 4 g = 10 mol).
- Die bei der isothermen Expansion aufgenommene Entropie beträgt [math] S_{12} = \Delta S_{12} = n R \ln{\frac{V_2}{V_1}}[/math] = 10 mol * 8.31 J/K/mol * ln(0.0179 m3 / 0.00831 m3) = 63.8 J/K. Die Entopieänderung des anderen isothermen Schrittes ist entgegengesetzt gleich: [math]S_{34} = \Delta S_{34} = n R \ln{\frac{V_4}{V_3}}[/math] = 10 mol * 8.31 J/K/mol * ln(0.00831 m3 / 0.0179 m3) = - 63.8 J/K (Logarithmus des reziproken Volumenverhältnis).
- Die beim isochoren Aufheizen aufzunehmende Entropie S41 ist gleich der Entropieänderung [math]\Delta S_{41} = - \Delta S_{23} = n \frac{3}{2} R \ln{\frac{T_{1}}{T_{4}}}[/math] = 10 mol * 1.5 * 8.31 J/K/mol * ln(800 K / 430 K) = 77.4 J/K.
- In reversibel geführten Kreisprozessen entspricht die Nettoarbeit der durch den Kreisprozess ausgeschnittenen Fläche im p-V-Diagramm. Diese Energie wird von der Entropie beim Durchlaufen des Stirling-Zyklus freigesetzt. Im T-S-Diagramm entspricht sie ebenfalls der vom Prozess eingeschlossenen Fläche. In den beiden isochoren Schritten ist die Arbeit 0 und die Fläche unter der T-S-Kurve für diese beiden Schritte entspricht deshalb der Änderung der inneren Energie. Weil die Änderung der inneren Energie nur von den beiden entgegengesetzt gleichen Temperaturänderungen abhängig ist, sind die Flächen unter der T-S-Kurve für die beiden isochoren Schritte ebenfalls entgegengesetzt gleich und kompensieren sich. Für die im T-S-Diagramm eingeschlossene Fläche müssen wir deshalb nur die Flächen unter den horizontalen Schritten berücksichtigen. Diese entsprechen der Energie, welche die Entropie ΔS12 bei der Temperatur T1 aufnimmt und bei T3 wieder abgibt (ΔS34 = - ΔS12): [math]W_{frei}=\Delta S_{12}(T_{12}-T_{34})[/math] = 63.8 J/K * (800 K - 430 K) = 23.6 kJ.