Lösung zu Badewanne: Unterschied zwischen den Versionen
Inhalt hinzugefügt Inhalt gelöscht
(Skizzen) |
Keine Bearbeitungszusammenfassung |
||
| (3 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
#Die zuzuführende Wärmeenergie ist gleich der Änderung der [[Enthalpie]] des Wassers <math>\Delta H = m c \Delta T</math> = 180 kg * 4.19kJ/(kgK) * 25 K = 18.86 MJ. Das sind 5.2 kWh elektrische Energie, 0.46 Liter Heizöl oder 0.0028 Ster Holz. |
#Die zuzuführende Wärmeenergie ist gleich der Änderung der [[Enthalpie]] des Wassers <math>\Delta H = m c \Delta T</math> = 180 kg * 4.19kJ/(kgK) * 25 K = 18.86 MJ. Das sind 5.2 kWh elektrische Energie, 0.46 Liter Heizöl oder 0.0028 Ster Holz. |
||
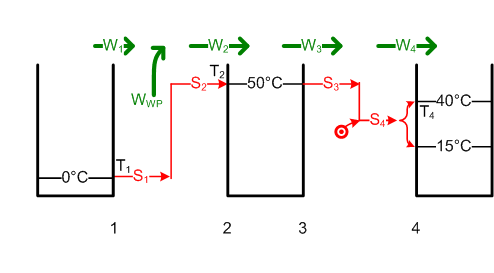
#Weil W<sub>3</sub> = W<sub>4</sub> = ΔH ist, ist die von der [[Wärmepumpe]] bei 50°C |
#Weil W<sub>3</sub> = W<sub>4</sub> = ΔH ist, ist die von der [[Wärmepumpe]] bei 50°C abgegebene Entropie S<sub>3</sub> gleich <math>S_3 = \frac {W_3}{T_2} = \frac {\Delta H}{T_2}</math> = 18.86 MJ / 323 K = 58.4 kJ/K. Um die Entropie S<sub>1</sub> = S<sub>2</sub> = S<sub>3</sub> um 50 K hinauf zu pumpen, benötigt die Wärmepumpe die Energie W<sub>WP</sub> im Umfang von <math>W_{WP} = (T_2 - T_1) \cdot S_1</math> = 50 K * 58.4 kJ/K = 2.92 MJ oder 0.81 kWh. [[Bild:Badewanne2.png]] |
||
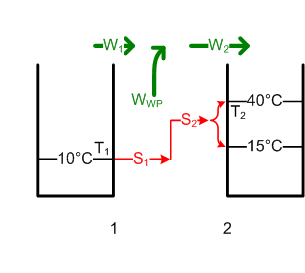
#Die [[Entropie]] des Badewassers nimmt um <math>\Delta S = m c \ln{\frac{T_{2e}}{T_{2a}}}</math> = 62.8 kJ/K zu. Die ausgetauschte Entropiemenge S<sub>2</sub>, welche diese Entropiezunahme ΔS bewirkte, ist gleich S<sub>1</sub>. Diese trägt eine Wärmeenergie von <math>W_1 = T_1 S_1</math> = 17.77 MJ aus dem Grundwasser in die Wärmepumpe hinein. Die Pumpe muss dann noch die Differenz zu W<sub>2</sub> aufbringen. Deshalb wird W<sub>WP</sub> = W<sub>2</sub> - W<sub>1</sub> = ΔH - W<sub>1</sub> = 1.09 MJ (0.3 kWh). [[Bild:Badewanne3.png]] |
#Die [[Entropie]] des Badewassers nimmt um <math>\Delta S = m c \ln{\frac{T_{2e}}{T_{2a}}}</math> = 180 kg * 4.19kJ/(kgK) * ln(313 K / 288 K) = 62.8 kJ/K zu. Die ausgetauschte Entropiemenge S<sub>2</sub>, welche diese Entropiezunahme ΔS bewirkte, ist gleich S<sub>1</sub>. Diese trägt eine Wärmeenergie von <math>W_1 = T_1 S_1</math> = 17.77 MJ aus dem Grundwasser in die Wärmepumpe hinein. Die Pumpe muss dann noch die Differenz zu W<sub>2</sub> aufbringen. Deshalb wird W<sub>WP</sub> = W<sub>2</sub> - W<sub>1</sub> = ΔH - W<sub>1</sub> = 18.86 MJ - 17.77 MJ = 1.09 MJ (0.3 kWh). [[Bild:Badewanne3.png]] |
||
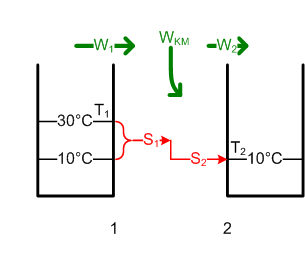
#Die Enthalpie des Badewassers ändert sich um <math>\Delta H = m c \Delta T</math> = -15.1 MJ und die Entropie um <math>\Delta S = m c \ln{\frac{T_{1e}}{T_{1a}}}</math> = -51.5 kJ/K. Die ausgetauschte Entropie S<sub>1</sub> ist gleich dieser Entropieänderung. Weil reversibel ist S1 = S2. S2 trägt <math>W2 = T_2 \cdot S_2 = T_2 \cdot \Delta S</math> = 14.6 MJ als thermische Energie in |
#Die Enthalpie des Badewassers ändert sich um <math>\Delta H = m c \Delta T</math> = 180 kg * 4.19kJ/(kgK) * (- 20 K) = -15.1 MJ und die Entropie um <math>\Delta S = m c \ln{\frac{T_{1e}}{T_{1a}}}</math> = 180 kg * 4.19kJ/kg/K * ln(283 K / 303 K) = - 51.5 kJ/K. Die ausgetauschte Entropie S<sub>1</sub> ist gleich dieser Entropieänderung. Weil reversibel, ist S1 = S2. S2 trägt <math>W2 = T_2 \cdot S_2 = T_2 \cdot (- \Delta S</math>) = 283 K * 51.5 kJ/K = 14.6 MJ als thermische Energie in das Grundwasser. Die Differenz W<sub>KM</sub> = W<sub>1</sub> - W<sub>2</sub> = - ΔH - W<sub>2</sub> = 15.1 MJ - 14.6 MJ = 0.5 MJ ist nutzbar. Eine Wärmekraftmaschine könnte also höchstens 0.5 MJ oder 0.14 kWh Energie zurückgewinnen. Also darf man den Stöpsel beruhigt herausziehen (bei 30°C ist das Baden auch nicht mehr so angenehm). [[Bild:Badewanne4.png]] |
||
'''[[Badewanne|Aufgabe]]''' |
'''[[Badewanne|Aufgabe]]''' |
||
Aktuelle Version vom 29. März 2011, 12:51 Uhr
- Die zuzuführende Wärmeenergie ist gleich der Änderung der Enthalpie des Wassers [math]\Delta H = m c \Delta T[/math] = 180 kg * 4.19kJ/(kgK) * 25 K = 18.86 MJ. Das sind 5.2 kWh elektrische Energie, 0.46 Liter Heizöl oder 0.0028 Ster Holz.
- Weil W3 = W4 = ΔH ist, ist die von der Wärmepumpe bei 50°C abgegebene Entropie S3 gleich [math]S_3 = \frac {W_3}{T_2} = \frac {\Delta H}{T_2}[/math] = 18.86 MJ / 323 K = 58.4 kJ/K. Um die Entropie S1 = S2 = S3 um 50 K hinauf zu pumpen, benötigt die Wärmepumpe die Energie WWP im Umfang von [math]W_{WP} = (T_2 - T_1) \cdot S_1[/math] = 50 K * 58.4 kJ/K = 2.92 MJ oder 0.81 kWh.
- Die Entropie des Badewassers nimmt um [math]\Delta S = m c \ln{\frac{T_{2e}}{T_{2a}}}[/math] = 180 kg * 4.19kJ/(kgK) * ln(313 K / 288 K) = 62.8 kJ/K zu. Die ausgetauschte Entropiemenge S2, welche diese Entropiezunahme ΔS bewirkte, ist gleich S1. Diese trägt eine Wärmeenergie von [math]W_1 = T_1 S_1[/math] = 17.77 MJ aus dem Grundwasser in die Wärmepumpe hinein. Die Pumpe muss dann noch die Differenz zu W2 aufbringen. Deshalb wird WWP = W2 - W1 = ΔH - W1 = 18.86 MJ - 17.77 MJ = 1.09 MJ (0.3 kWh).
- Die Enthalpie des Badewassers ändert sich um [math]\Delta H = m c \Delta T[/math] = 180 kg * 4.19kJ/(kgK) * (- 20 K) = -15.1 MJ und die Entropie um [math]\Delta S = m c \ln{\frac{T_{1e}}{T_{1a}}}[/math] = 180 kg * 4.19kJ/kg/K * ln(283 K / 303 K) = - 51.5 kJ/K. Die ausgetauschte Entropie S1 ist gleich dieser Entropieänderung. Weil reversibel, ist S1 = S2. S2 trägt [math]W2 = T_2 \cdot S_2 = T_2 \cdot (- \Delta S[/math]) = 283 K * 51.5 kJ/K = 14.6 MJ als thermische Energie in das Grundwasser. Die Differenz WKM = W1 - W2 = - ΔH - W2 = 15.1 MJ - 14.6 MJ = 0.5 MJ ist nutzbar. Eine Wärmekraftmaschine könnte also höchstens 0.5 MJ oder 0.14 kWh Energie zurückgewinnen. Also darf man den Stöpsel beruhigt herausziehen (bei 30°C ist das Baden auch nicht mehr so angenehm).