Carnotor: Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) |
Admin (Diskussion | Beiträge) Keine Bearbeitungszusammenfassung |
||
| Zeile 1: | Zeile 1: | ||
Der von Sadi Carnot eingeführte [[Carnot-Prozess|Zyklus]] wird heute noch dazu verwendet, den Begriff [[Entropie]] einzuführen. |
Der von Sadi Carnot eingeführte [[Carnot-Prozess|Zyklus]] wird heute noch dazu verwendet, den Begriff [[Entropie]] einzuführen. Doch zweihundert Jahre nach der Veröffentlichung der genialen Schrift von Carnot sollte man nicht mehr so tun, als ob die Entropie erst vor kurzem entdeckt worden sei. Heute, da wir wissen, dass die [[Entropie]] die grundlegende Grösse der [[Thermodynamik]] ist, muss diese Grösse nicht mehr mühsam und dennoch nur halbrichtig über den [[Carnot-Prozess]] eingeführt werden. Will man die Zustandsänderungen des idealen Gases dennoch diskutieren und durchrechnen, kann man dies mit Hilfe des Carnotors tun. Der Carnotor ist eine virtuelle Maschine, die an der [[ZHW]] "erfunden" worden ist, um das Verhalten der Gase mit Hilfe von systemdynamischen Werkzeugen zu modellieren. Selbstverständlich kann der Carnotor mit irgendeinem honogenen Stoff bestückt werden, falls die Stoffeigenschaften durch die Zustandsgleichungen beschrieben sind. |
||
==ideales Gas== |
==ideales Gas== |
||
| Zeile 12: | Zeile 12: | ||
:<math>S = S_0 + n (R ln \frac {V}{V_0} + \hat c_V ln \frac {T}{T_0})</math> |
:<math>S = S_0 + n (R ln \frac {V}{V_0} + \hat c_V ln \frac {T}{T_0})</math> |
||
Die Entropie nimmt logarithmisch mit dem Volumen und der Temperatur zu und ist proportional zur Stoffmenge. Auf ein Mol bezogen bildet die universelle Gaskonstante ''R'' den Proportionalitätsfaktor für den volumenmässige und die molare [[Wärmekapazität]] den Faktor für den thermischen Zuwachs. |
Die Entropie nimmt logarithmisch mit dem Volumen und der Temperatur zu und ist proportional zur Stoffmenge. Auf ein Mol bezogen bildet die universelle Gaskonstante ''R'' den Proportionalitätsfaktor für den volumenmässige und die molare [[Wärmekapazität]] den Faktor für den thermischen Zuwachs an Entropie. |
||
==Zweiport== |
==Zweiport== |
||
| Zeile 18: | Zeile 18: | ||
Der Zustand des idealen Gases kann auf zwei Arten verändert werden: durch heizen und kühlen oder durch komprimieren und entspannen. Um diese Prozesse kontrolliert ablaufen zu lassen, soll das Gas in einen Zylinder gebracht werden, der mit einem frei verschiebbaren Kolben abgeschlossen ist. Der Zylinderboden sei ideal wärmedurchlässig (diatherm), besitze aber selber keine [[Wärmekapazität]]. Die Zylinderwände und der Kolben sind absolut wärmeisoliert (adiabatisch). Der reibunsfrei verschiebbare Kolben schliesst das Gas hermetisch gegen eine inkompressible Flüssigkeit ab, welche für den Druckaufbau verantwortlich ist. |
Der Zustand des idealen Gases kann auf zwei Arten verändert werden: durch heizen und kühlen oder durch komprimieren und entspannen. Um diese Prozesse kontrolliert ablaufen zu lassen, soll das Gas in einen Zylinder gebracht werden, der mit einem frei verschiebbaren Kolben abgeschlossen ist. Der Zylinderboden sei ideal wärmedurchlässig (diatherm), besitze aber selber keine [[Wärmekapazität]]. Die Zylinderwände und der Kolben sind absolut wärmeisoliert (adiabatisch). Der reibunsfrei verschiebbare Kolben schliesst das Gas hermetisch gegen eine inkompressible Flüssigkeit ab, welche für den Druckaufbau verantwortlich ist. |
||
Das um die ideale Flüssigkeit erweiterte Gas besitzt zwei |
Das um die ideale Flüssigkeit erweiterte Gas besitzt zwei [[Port]]s (Eingänge oder Ausgänge). Über den thermischen Port wird [[Entropie]] und über den hydraulischen [[Volumen]] ausgetauscht. Die Volumen- und die Entropieströme sind je nach [[Druck]] und [[Temperatur]] mit [[Energie]] beladen (der Druck ist das hydraulische und die Temperatur das thermische [[Potenzial]]). Die vier grundlegenden Prozesse der [[Thermodynamik]] hängen nun nur noch von der Beschaltung der beiden Ports ab. |
||
{| |
{| |
||
Version vom 30. Mai 2007, 05:36 Uhr
Der von Sadi Carnot eingeführte Zyklus wird heute noch dazu verwendet, den Begriff Entropie einzuführen. Doch zweihundert Jahre nach der Veröffentlichung der genialen Schrift von Carnot sollte man nicht mehr so tun, als ob die Entropie erst vor kurzem entdeckt worden sei. Heute, da wir wissen, dass die Entropie die grundlegende Grösse der Thermodynamik ist, muss diese Grösse nicht mehr mühsam und dennoch nur halbrichtig über den Carnot-Prozess eingeführt werden. Will man die Zustandsänderungen des idealen Gases dennoch diskutieren und durchrechnen, kann man dies mit Hilfe des Carnotors tun. Der Carnotor ist eine virtuelle Maschine, die an der ZHW "erfunden" worden ist, um das Verhalten der Gase mit Hilfe von systemdynamischen Werkzeugen zu modellieren. Selbstverständlich kann der Carnotor mit irgendeinem honogenen Stoff bestückt werden, falls die Stoffeigenschaften durch die Zustandsgleichungen beschrieben sind.
ideales Gas
Das Modell des idealen Gases beschreibt den Zustand von stark verdünnten Stoffen, wobei die Wechselwirkung zwischen den Teilchen dieses Stoffes vernachlässigbar klein sein sollte. Sämtliche Gleichgewichtszustände des idealen Gases können mit Hilfe von zwei Zustandsgleichungen beschrieben werden.
Die thermische Zustandsgleichung oder das universelle Gasgesetz verknüpft vier Grössen, die Temperatur, den Druck, das Volumen und die Stoffmenge miteinander
- [math]pV = nRT[/math]
Anstelle der kalorischen nimmt man als zweite Zustandsgleichung mit Vorteil die entropische. Sie beschreibt, wie die Entropie vom Volumen und der Temperatur abhängt
- [math]S = S_0 + n (R ln \frac {V}{V_0} + \hat c_V ln \frac {T}{T_0})[/math]
Die Entropie nimmt logarithmisch mit dem Volumen und der Temperatur zu und ist proportional zur Stoffmenge. Auf ein Mol bezogen bildet die universelle Gaskonstante R den Proportionalitätsfaktor für den volumenmässige und die molare Wärmekapazität den Faktor für den thermischen Zuwachs an Entropie.
Zweiport
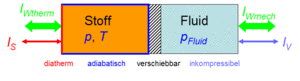
Der Zustand des idealen Gases kann auf zwei Arten verändert werden: durch heizen und kühlen oder durch komprimieren und entspannen. Um diese Prozesse kontrolliert ablaufen zu lassen, soll das Gas in einen Zylinder gebracht werden, der mit einem frei verschiebbaren Kolben abgeschlossen ist. Der Zylinderboden sei ideal wärmedurchlässig (diatherm), besitze aber selber keine Wärmekapazität. Die Zylinderwände und der Kolben sind absolut wärmeisoliert (adiabatisch). Der reibunsfrei verschiebbare Kolben schliesst das Gas hermetisch gegen eine inkompressible Flüssigkeit ab, welche für den Druckaufbau verantwortlich ist.
Das um die ideale Flüssigkeit erweiterte Gas besitzt zwei Ports (Eingänge oder Ausgänge). Über den thermischen Port wird Entropie und über den hydraulischen Volumen ausgetauscht. Die Volumen- und die Entropieströme sind je nach Druck und Temperatur mit Energie beladen (der Druck ist das hydraulische und die Temperatur das thermische Potenzial). Die vier grundlegenden Prozesse der Thermodynamik hängen nun nur noch von der Beschaltung der beiden Ports ab.
| Prozess | thermischer Port | hydraulischer Port |
|---|---|---|
| isochor | aktiv | geschlossen |
| isobar | aktiv | offen |
| isotherm | offen | aktiv |
| isentrop | geschlossen | aktiv |
Systemdynamisches Modell
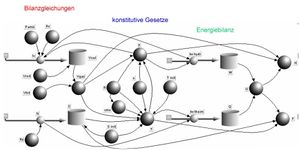
Das systemdynamische Modell geht von der Entropie- und der Volumenbilanz aus (bilanziert wird das Volumen der Flüssigkeit; das Volumen des Gases ist dann die Ergänzung zum Gesamtvolumen). Die beiden Potenziale, die Temperatur und der Druck, werden über die beiden Zustandsgleichungen ermittelt. Die Energie bildet wie überall in der Physik eine zweite Ebene. Aus den beiden zugeordneten Energieströmen werden die Wärme und die Arbeit integriert. Die Summe über die beiden Austauschformen ergibt dann die Änderung der inneren Energie. Die Enthalpie und die freie Energie werden a posteriori berechnet.
Im Gegensatz zur üblichen quasistatischen Diskussion der vier grundlegenden Prozesse, kann man nun beim aktiven Port des Carnotors eine beliebige Stromstärke aufschalten (Entropiestrom- oder Volumenstrom- Zeit- Funktion). Der passive Port muss dann entweder offen oder geschlossen sein. Ist der thermische Anschluss aktiv und der hydraulische geschlossen, liegt ein isochorer Prozess vor. Bei aktivem hydraulische und geschlossenem thermischen Port findet ein isentroper Prozess statt. Der isotherme (hydraulischer Anschluss aktiv) und der isobare (thermische Anschluss aktiv) können nicht ideal modelliert werden, weil der jeweils andere Port wärmeleitend (isotherm) bzw. Volumen leitend (isobar) mit der Umgebung verbunden werden muss. Im Idealfall der reversiblen Prozessführung müsste der zugehörige Leitwert gegen unendlich streben. Die Grösse dieses Leitwerts ist aber von der Numerik her begrenzt.