Carnotor und ideales Gas: Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) |
Admin (Diskussion | Beiträge) |
||
| Zeile 146: | Zeile 146: | ||
===mikroskopisches Verständnis=== |
===mikroskopisches Verständnis=== |
||
Das Verhalten des idealen Gases lässt sich ein Stück weit mit der [[kinetischen Gastheorie]] erklären. Die kinetische Gastheorie geht von ununterscheidbaren Teilchen aus, die keine inneren Freiheitsgrade besitzen. Die Wechselwirkung dieser Teilchen beschränkt sich auf kurze, elastische Stösse. Im Modell des idealen Gases entspricht die temperaturbedingte Zunahme der inneren Energie einer Vergrösserung der mittleren kinetischen Energie der Teilchen. In diesem Modell ist die Entropie ein Mass für die Zahl der möglichen Anordnungen der Teilchen im [[Phasenraum]] bei gegebenem Zustand (Volumen und Temperatur). Der Phasenraum umfasst den gewöhnlichen Raum plus den Impulsraum. Vergrössert sich das Volumen, bekommen die Teilchen mehr Möglichkeiten, sich im Raum zu verteilen. Bei steigender Temperatur vergrössert sich die Zahl der möglichen Anordnungen im Impulsraum, weil der Mittelwert des Quadrats der Teilchengeschwindigkeit steigt. |
|||
Die kinetische Gastheorie ist die Quelle vieler Irrtümer. Dazu gehören |
|||
#Thermodynamik kann auf die Mechanik von Vielteilchensystemen zurückgeführt werden |
|||
#Entropie ist ein Mass für die Unordnung |
|||
#Innere Energie ist kinetische Energie |
|||
Die erste Behauptung hält sich seit ihrer Begründung im 19. Jahrhundert mit erstaunlicher Hartnäckigkeit. Bestimmte Eigenschaften von Stoffen lassen sich mittels mechanischer Modelle erklären. Dabei handelt es sich aber nicht um eine umfassende Rückführung der Thermodynamk auf Mechanik. Mit der zweiten Behauptung wird die Grundgrösse der Thermodynamik diffamiert. Unordung ist nicht mathematisch erklärbar und erfüllt keine Bilanzgleichung. Hinter der Gleichsetzung von Entropie mit Unordnung steckt der Begriff der [[Zustandssumme]], der Zahl der Realisierungsmöglichkeiten ununterscheidbarer Teilchen in einem thermodynamischen Zustand. Erschwerend kommt hinzu, dass diese Zustandsssumme beim idealen Gas nicht normierbar ist. Das kann man auch an der oben hergeleiteten Abhängigkeit der Entropie vom Volumen und Druck erkennen. Lässt man die Temperatur oder den Druck gegen Null gehen, divergiert die Entropie gegen minus Unendlich. Die dritte Behauptung vermischt die Systemgrenzen. Ein einzelnes Teilchen speichert zu jedem Zeitpunkt Impuls und damit verbunden kinetische Energie. Das Gas als Gesamtsystem speichert im Ruhesystem weder Impuls noch kinetische Energie. |
|||
==Simulation== |
==Simulation== |
||
Version vom 22. Januar 2008, 08:56 Uhr
Das ideale Gas liefert ein einfachstes Modell, um thermodynamischen Prozesse, wie sie in Wärmepumpen und Wärmekraftmaschinen (Dampfmaschinen, Verbrennungsmotoren und Gasturbinen) ablaufen, zu verstehen. Zur Beschreibung homogener, thermodynamischer Systeme benötigt man mindestens zwei Bilanzgleichungen, die Entropiebilanz und die Volumenbilanz. Folglich müssen aus den Bilanzgleichungen auch zwei Potenziale berechnet werden. Solche Doppelspeicher sind entsprechend komplexer zu beschreiben als etwa ein Hydrospeicher (Druck berechnet sich aus dem Volumen), ein bewegter Körper (Geschwindigkeit folgt aus dem Impulsinhalt) oder ein Kondensator (Spannung hängt direkt mit der Ladung zusammen). Erschwerend kommt hinzu, dass in der Thermodynamik viele Grössen auf die Energie bezogen angegeben werden. Damit sie in einem dynamischen Modell eingesetzt werden können, müssen sie dann zuerst auf die Entropie umgerechnet werden.
Lernziele
Carnotor
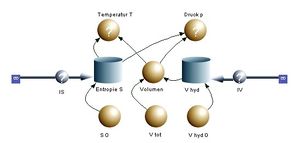
Der Carnotor, der schon in der letzten Vorlesung eingeführt worden ist, dient dem Verständnis der thermodynamischen Basisprozesse. Nachfolgend wird der Bau eines systemdynamischen Modells des Carnotors Schritt für Schritt erklärt.
Die Impulsbilanz und die Volumenbilanz bilden das Rückgrat des Carnotors. Aus der Volumenbilanz ist dann unter Beizug des gesamten, zur Verfügung stehenden Volumens Vtot das dem zu modellierenden Stoff zur Verfügung stehende Volumen zu berechnen.
- [math]V=V_{tot}-V_{hyd}[/math]
Nun hängt die Temperatur nicht ausschliesslich vom Entropieinhalt ab. Die Temperatur ist eine Funktion des Entropie und des Volumens. Dies kann mit einem einfachen Experiment gezeigt werden. Presst man Luft schnell zusammen und lässt sie kurz danach wieder expandieren, steigt die Temperatur an und sinkt danach wieder ungefähr auf den ursprünglichen Wert ab. Da in erster Näherung die Entropieproduktion und die Wärmeleitung vernachlässigt werden kann, bleibt die Entropie konstant. Folglich steigt die Temperatur mit abnehmendem Volumen bei konstant gehaltener Entropie.
Wie die Temperatur ist der Druck eine Funktion des Volumens und der Entropie. Heizt man ein Gas bei konstantem Volumen auf, steigt neben der Temperatur auch der Druck an. Das Basismodell des Carnotors besteht folglich aus einer Volumen- und einer Entropiebilanz. Druck und Temperatur lassen sich dann aus dem aktuellen Volumen und dem momentanen Entropieinhalt berechnen. Die zugehörigen Beziehungen nennt man konstitutive Gesetze. Die konstitutiven Gesetze des idealen Gases werden weiter unten eingeführt.
vier Basisprozesse
Von den vier Basisprozessen sind das isochore Heizen oder Kühlen (Volumen konstant) sowie das isentrope Komprimieren oder Expandieren (Entropie konstant) einfach zu modellieren. Auf der einen Seite wird Entropie bzw. Volumen zu- oder abgeführt. Der andere Strom ist dann auf Null zu setzen. Etwas schwieriger gestaltet sich das isobare Heizen oder Kühlen (Druck konstant) sowie das isotherme Komprimieren oder Expandieren (Temperatur konstant). Auf der einen Seite wird wieder ein Entropie- bzw. Volumenstrom vorgegeben (aufgeprägt). In der andern Zuleitung ist der Strom so freizugeben, dass der Druck bzw. die Temperatur des Systems auf einem konstanten Wert bleibt. Modellmässig und auch in Wirklichkeit ist eine totale Freigabe eines Stromes nicht möglich. Um eine möglichst gute Druck- oder Temperaturstabilität zu erreichen, führen wir einen möglichst grossen Volumen- oder Entropieleitwert. Zudem nehmen wir an, dass der Carnotor über den Volumenleitwert GV an ein riesiges hydraulisches System mit dem Druck p0 bzw. über den Entropieleitwert GS an ein Wärmebad der Temperatur T0 angekoppelt sei. Die Gleichungen für die beiden Zuleitungen lauten dann
- [math]I_S=G_S(T_0-T)[/math] und [math]I_V=G_V(p_0-p)[/math]
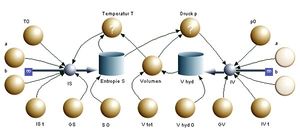
Für die vier Basisprozesse gelten folgende Zuordnungen (ein aufgeprägter Strom wird hier mit I(t) bezeichnet)
| Prozess | Entropiestrom | Volumenstrom | a | b |
|---|---|---|---|---|
| isochor | IS(t) | 0 | 0 | 0 |
| isobar | IS(t) | GVΔ p | 0 | 1 |
| isentrop | 0 | IV(t) | 1 | 0 |
| isotherm | GSΔT | IV(t) | 1 | 1 |
Der Binärcode ab erlaubt nun, die Stromstärken für die vier Basisprozesse zu steuern
- [math]I_S=(1-a)I_S(t)+abG_S\Delta T[/math]
- [math]I_V=aI_V(t)+(1-a)bG_V\Delta p[/math]
Die beiden aufgeprägten Ströme können innerhalb bestimmter Grenzen beliebig gewählt werden.
Energieebene
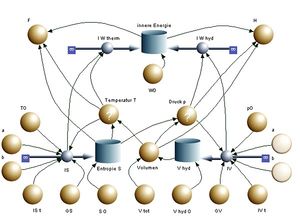
Die Energiebilanz lässt sich als zweite Ebene ins Modell einfügen. Dazu bildet man die beiden zugeordneten Energieströme
- [math]I_{W_{therm}}=TI_S[/math] und [math]I_{W_{hyd}}=pI_V[/math]
und lässt beide in den Topf innere Energie hinein fliessen. Der Startwert der inneren Energie kann wie die Anfangsentropie frei gewählt werden. Die Enthalpie H und die freie Energie F lassen sich dann mittels einer einfachen Formel bestimmen
- [math]H=U+pV[/math]
- [math]F=U-TS[/math]
Die Änderung der Enthalpie entspricht bei isobarem Heizen oder Kühlen der zu- oder abgeführten Wärme. Die Enthalpie darf deshalb bei einem System, das mit einem Druckspeicher verbunden ist, als eine Art "Wärmeinhalt" bezeichnet werden. Die Änderung der freien Energie entspricht bei isothermer Expansion oder Kompression der mechanisch ausgetauschten Energie. Ist also ein Stoff an ein Wärmebad gekoppelt, steht die freie Energie für das "Arbeitsvermögen" dieses Stoffes.
ideales Gas
erste Gesetze
1661 stellte Robert Boyle (1627-1691) experimentell fest, dass das Volumen einer bestimmten Gasprobe dem absoluten Druck umgekehrt proportional ist. Das Boylesche Gesetz lautet demnach
- [math]pV=konst.[/math]
falls sich die Temperatur und die Gasmenge nicht ändert. Der Druck eines Gases in Abhängigkeit der Temperatur wurde 1701 von Guillaume Amontons (1663-1705) untersucht. Er fand, dass der Druck eine lineare Funktion der Celsius-Temperatur ist und dass der Druck bei -273 °C verschwinden müsste. Er definierte deshalb eine absolute Temperaturskala, die man heute Kelvin-Skala nennt und gegenüber der Celsius-Skala um 273°C in den Minusbereich verschoben ist. Die Beziehung, wonach der Druck zur absoluten Temperatur proportional ist, wurde von Joseph Gay-Lussac (1778-1850) wieder veröffentlicht und trägt heute seinen Namen
- [math]\frac{p}{T}=konst.[/math]
falls sich das Volumen und die Gasmenge nicht ändert. Amadeo Avogadro (1776-1856) stellte die Hypothese auf, dass gleiche Gasvolumina bei gleicher Temperatur und gleichem Druck dieselbe Anzahl von Teilchen enthalten. Weil die Teilchenzahl makroskopisch gleich der Stoffmenge ist, muss bei gegebener Temperatur und gegebenem Druck das Gasvolumen proportional zur Stoffmenge n sein
- [math]\frac{V}{n}=konst[/math]
thermische Zusstandsgleichung
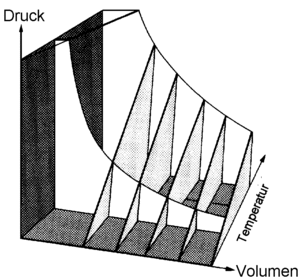
Das Boylesche Gesetz besagt, dass das Produkt aus Volumen und Druck eine Funktion der Temperatur und der Stoffmenge f(T,n) ist. Gemäss dem Gesetz von Gay-Lussac ist der Quotient aus Druck und Temperatur nur noch eine Funktion des Volumens und der Stoffmenge g(V,n). Die Hypothese von Avogadro besagt, dass das molare Volumen nur noch eine Funktion des Drucks und der Temperatur h(p.T) ist. Kombiniert man diese drei Gesetzmässigkeiten, folgt
- [math]\frac{pV}{nT}=\frac{f(T,n)}{nT}=\frac{g(V,n)V}{n}=\frac{h(p,T)p}{T}[/math]
Weil keine der vier Variablen in allen drei rechten Termen vorkommt, hängt der Ausdruck links von keiner dieser Grössen ab. Folglich muss dieser Ausdruck absolut konstant sein. Wir postulieren deshalb, dass der absolute Druck mal das Volumen dividiert durch die Stoffmenge und die absolute Temperatur gleich einer universellen Konstante R (R = 8.314 J/(mol K) ist
- [math]pV=nRT[/math]
Alle gasförmigen Stoffe nähern sich bei genügend grosser Verdünnung dieser Gesetzmässigkeit an. Deshalb nennt man diesen Zusammenhang auch thermische Zustandsgleichung des idealen Gases.
kalorische Zustandsgleichung
Vernachlässigt man die Wechselwirkung zwischen den Teilchen des Gases, hängt seine innere Energie nicht mehr vom Volumen ab. Die temperaturbedingte Zunahme der Energie ist proportional zur Temperatur. Im Proportionalitätsfaktor, der Wärmekapazität, steckt die Beweglichkeit der Teilchen: die molare Wärmekapazität eines Gases nimmt bei isochorem Heizen pro Freiheitsgrad f um die Hälfte der Gaskonstante R zu
- [math]\Delta W=C\Delta T=n\hat c_V \Delta T=n\frac f2 R \Delta T[/math]
Der Index V weisst darauf hin, dass sich die Kapazität auf die Änderung der inneren Energie beim isochoren Heizen und nicht auf die Änderung der Enthalpie beim isobaren Heizen bezieht. Als Freiheitsgrad gelten die Translationsbewegung (drei Freiheitsgrade) und die Rotationsbewegung der Teilchen (bis zu 3 Freiheitsgrade). Schwingungen zwischen den Atomen eines Moleküls ergeben weitere Freiheitsgrade. Weil die Atome der Edelgase nicht rotieren können, besitzen diese Teilchen nur die minimale Zahl von drei Freiheitsgraden. Die Moleküle der Luft (Stickstoff und Sauerstoff) bewegen sich frei im Raum und können sich - wie alle zweiatomigen Moleküle - um Achsen drehen, die eine Ebene aufspannen. Folglich besitzen die Teilchen der Luft fünf Freiheistgrade. Damit ergibt sich die folgende Temperaturabhängigkeit der inneren Energie
- Edelgase: [math]\Delta W=n\frac{3R}{2} \Delta T[/math]
- Luft: [math]\Delta W=n\frac {5R}{2} \Delta T[/math]
Die Atome der Metalle (feste, kristalline Körper) weisen bei genügend hoher Temperatur sechs Freiheitsgrade auf, weil sie in alle Richtungen elastisch eingebunden sind (jeder Schwingungsmodus ergibt zwei Freiheitsgrade).
Entropie
Modellmässig ist das ideale Gas durch die thermische und die kalorische Zustandsgleichung beschrieben. Für unser systemdynamisches Modell müssen wir aber wissen, wie die Mengen Volumen und Entropie die Potenziale Druck und Temperatur bestimmen. Zu diesem Zweck untersuchen wir, wie die Entropie des idealen Gases von der Temperatur und vom Volumen abhängt. In der letzten Vorlesung haben Sie gelernt, wie der Zuwachs an inneren Energie mit der Entropie und dem Volumen zusammenhängt
- [math]\dot W=T\dot S-p\dot V[/math]
Diese Formel ergibt sich direkt aus dem thermisch und dem hydraulisch zugeordnetem Energiestrom
Die Temperaturabhängigkeit der Entropie folgt direkt aus der kalorischen Zustandsgleichung. Heizt man bei konstantem Volumen, ist die Änderungsrate der Entropie gleich der Änderungsrate der Energie dividiert durch die absolute Temperatur
- [math]\dot S=\frac{\dot W}{T}=C_V\frac{\dot T}{T}[/math]
Die Energiekapazität oder Wärmekapazität bei konstantem Volumen ist entweder gleich Masse mal spezifische Wärmekapazität oder gleich Stoffmenge mal molare Wärmekapazität. Integriert man diese Beziehung über einen Zeitabschnitt oder über eine Temperaturdifferenz, folg
- [math]\Delta S=\int C_V\frac{\dot T}{T} dt=\int_{T_1}^{T_2} C_V\frac{dT}{T}=C_V\ln{\frac{T_2}{T_1}}[/math]
Die letzte Umformung ist nur möglich, wenn die Wärmekapazität selber nicht von der Temperatur abhängt. Diese Kapazität ist beim idealen Gas gleich
- [math]C_V=\frac f2 nR[/math]
Im Gegensatz zur inneren Energie hängt die Entropie auch noch vom Volumen ab. Komprimiert man ein Gas bei konstant gehaltener Temperatur, bleibt die innere Energie konstant (Arbeit wandelt sich direkt in Wärme um). Folglich ist
- [math]\dot S=-\frac pT \dot V[/math]
Der Quotient aus Druck und Temperatur kann mit Hilfe der thermischen Zustandsgleichung (universelles Gasgesetz) ersetzt werden. Eine Integration liefert dann den gesuchten Zusammenhang
- [math]\Delta S=-\int\frac pT \dot V dt=-\int\frac{nR}{V}\dot V dt=nR\int_{V_2}^{V_1}\frac{dV}{V}=nR\ln{\frac {V_1}{V_2}}[/math]
Nach dem dritten Gleichheitszeichen ist das Minuszeichen verschwunden, weil die Grenzen des bestimmten Integrals vertauscht worden sind. Die Erkenntnisse aus der isochoren und der isothermen Zustandsänderungen ergeben die Entropie in Funktion des Volumens und der Temperatur des idealen Gases
- [math]S(T,V)=S(T_0,V_0)+\frac{nfR}{2}\ln{\frac{T}{T_0}}+nR\ln{\frac{V_0}{V}}[/math]
Die Entropie des idealen Gases nimmt mit dem Logarithmus des Temperaturverhältnisses zu und mit dem Logarithmus des Volumenverhältnisses ab.
mikroskopisches Verständnis
Das Verhalten des idealen Gases lässt sich ein Stück weit mit der kinetischen Gastheorie erklären. Die kinetische Gastheorie geht von ununterscheidbaren Teilchen aus, die keine inneren Freiheitsgrade besitzen. Die Wechselwirkung dieser Teilchen beschränkt sich auf kurze, elastische Stösse. Im Modell des idealen Gases entspricht die temperaturbedingte Zunahme der inneren Energie einer Vergrösserung der mittleren kinetischen Energie der Teilchen. In diesem Modell ist die Entropie ein Mass für die Zahl der möglichen Anordnungen der Teilchen im Phasenraum bei gegebenem Zustand (Volumen und Temperatur). Der Phasenraum umfasst den gewöhnlichen Raum plus den Impulsraum. Vergrössert sich das Volumen, bekommen die Teilchen mehr Möglichkeiten, sich im Raum zu verteilen. Bei steigender Temperatur vergrössert sich die Zahl der möglichen Anordnungen im Impulsraum, weil der Mittelwert des Quadrats der Teilchengeschwindigkeit steigt.
Die kinetische Gastheorie ist die Quelle vieler Irrtümer. Dazu gehören
- Thermodynamik kann auf die Mechanik von Vielteilchensystemen zurückgeführt werden
- Entropie ist ein Mass für die Unordnung
- Innere Energie ist kinetische Energie
Die erste Behauptung hält sich seit ihrer Begründung im 19. Jahrhundert mit erstaunlicher Hartnäckigkeit. Bestimmte Eigenschaften von Stoffen lassen sich mittels mechanischer Modelle erklären. Dabei handelt es sich aber nicht um eine umfassende Rückführung der Thermodynamk auf Mechanik. Mit der zweiten Behauptung wird die Grundgrösse der Thermodynamik diffamiert. Unordung ist nicht mathematisch erklärbar und erfüllt keine Bilanzgleichung. Hinter der Gleichsetzung von Entropie mit Unordnung steckt der Begriff der Zustandssumme, der Zahl der Realisierungsmöglichkeiten ununterscheidbarer Teilchen in einem thermodynamischen Zustand. Erschwerend kommt hinzu, dass diese Zustandsssumme beim idealen Gas nicht normierbar ist. Das kann man auch an der oben hergeleiteten Abhängigkeit der Entropie vom Volumen und Druck erkennen. Lässt man die Temperatur oder den Druck gegen Null gehen, divergiert die Entropie gegen minus Unendlich. Die dritte Behauptung vermischt die Systemgrenzen. Ein einzelnes Teilchen speichert zu jedem Zeitpunkt Impuls und damit verbunden kinetische Energie. Das Gas als Gesamtsystem speichert im Ruhesystem weder Impuls noch kinetische Energie.