Reale Stoffe
In der Vorlesung zu Entropie und Enthalpie haben wir uns ein erstes Mal mit dem thermischen Verhalten realer Stoffe beschäftigt. Damals ging es ums Kühlen und Heizen bei konstantem Druck. In dieser Vorlesung untersuchen wir das Verhalten realer Stoffe unter Veränderung beider Potenzialgrössen (Temperatur und Druck). Wie beim idealen Gas stellen wir uns die Prozesse als ideal (reversibel) vor und lassen sie unter kontrollierten Bedingungen im Carnotor ablaufen. Dampfmaschinen können mit Hilfe des Rankine-Zyklus beschrieben werden. Für Wärmepumpen kann ein ähnlicher Zyklus gefunden werden.
Lernziele
In dieser Vorlesung lernen Sie
- die Zustandsfläche eines homogenen Stoffes sowie
- das Phasendiagramm als zugehörige Projektion auf die p-T-Ebene und
- das Arbeitsdiagramm als zugehörige Projektion auf die p-V-Ebene kennen
- die Definition der relativen Luftfeuchtigkeit
- wie ein Wärme- oder Kältepumpe funktioniert
thermische Zustandsfläche
ideales Gas
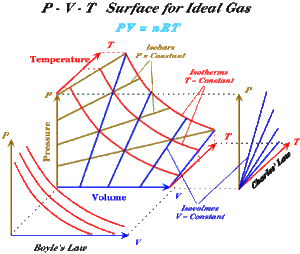
Trägt man alle Gleichgewichtszustände des idealen Gases in ein Druck-Temperatur-Volumen-Schaubild ein, erhält man eine Zustandsfläche, welche bei T = 0 entlang der Druck- und Volumenachse verläuft und sich bei höheren Temperaturen immer mehr von der Temperaturachse entfernt. Auf dieser Zustandsfläche lassen sich auf einfache Art und Weise drei verschiedene Kurvenscharen konstruieren
- die Isobaren: Schnittkurven der Zustandsfläche mit Ebenen die normal zur Druckachse stehen
- die Isochoren: Schnittkurven der Zustandsfläche mit Ebenen, die die normal zur Volumenachse stehen
- Isothermen: Schnittkurven der Zustandsfläche mit Ebenen, die normal zur Temperaturachse stehen
Projiziert man die Zustandsfläche auf die p-V-Ebene, stellen die Isothermen das Boylsche Gesetz dar. Eine Projektion auf die p-T-Ebene liefert die Kurvenschar der Isochoren (Gay-Lussac-Gesetz). Eine dritte Projektion auf die T-V-Ebene zeigt die Isobaren. Drei der vier möglichen Basisprozesse des idealen Gases lassen sich so direkt auf der Zustandsfläche einzeichnen. Einzig der isentrope Prozess ergibt eine Linie, die schief über die Zustandsfläche läuft.
Eine Zustandsänderung muss weder isochor, isobar, isentrop noch isotherm verlaufen. Jede Abfolge von Gleichgewichtszuständen lässt sich auf der Zustandsfläche einzeichnen und auf eine der drei Koordinatenebenen projizieren. Die Darstellung im p-V-Diagramm nennt man auch Arbeitsdiagramm, weil die Fläche unter der Kurve der vom Gas in Form von Arbeit abgegebenen Energie entspricht. Im Arbeitsdiagramm erscheinen die Isobaren als horizontale und die Isochoren als vertikale Linien. Die Isothermen bilden für das ideale Gas eine Schar von Hyperbeln.
reale Stoffe
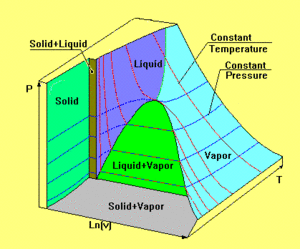
Reale Stoffe besitzen eine viel komplexere Zustandsfläche als das ideale Gas. In der nebenstehend abgebildeten Graphik ist die Zustandsfläche eines homogenen Stoffes dargestellt, wobei die drei Achsen nicht massstäblich aufgetragen sind. Durch Kanten getrennt zerfällt die Zustandsfläche in fünf Teile. Die grösste Teilfläche, die bei hoher Temperatur asymptotisch in die Zustandsfläche des idealen Gases übergeht, beschreibt alle Gleichgewichtszustände der gasförmigen und flüssigen Phase. Dazwischen erstreckt sich das Koexistenzgebiet flüssig-gasförmig. Entsprechend dem zur Verfügung stehenden Volumen liegt hier ein Teil des Stoffes im gasförmigen und der Rest im flüssigen Zustand vor. Dieses Stück der Zustandsfläche umschlingt die Volumenachse zylinderförmig. Die beiden andern Koexistenzgebiete (fest-gasförmig und fest-flüssig) sind ebenfalls zylinderförmig. Die gemeinsame Kante der drei Koexistenzgebiete heisst Tripellinie, weil bei diesem Druck und bei dieser Temperatur alle drei Phasen (fest, flüssig und gasfärmig) koexistieren. Die fünfte Teilfläche beschreibt den festen Zustand unter isotropem Druck. Weil ein Festkörper auch Scherspannungen aufnehmen kann, lassen sich nicht alle möglichen Gleichgewichtszustände des festen Körpers in diesem Diagramm darstellen.
Der alltägliche Heizprozess verläuft längs einer Isobaren, weil unsere Atmosphäre den Druck bei etwa einem Bar stabilisiert. Liegt die Tripellinie höher als der atmosphärische Druck, wird der Stoff unter normalen Bedingungen nie flüssig. Dieses Verhalten ist beim Kohlenstoffdioxid bestens bekannt. Der Name Trockeneis leitet sich aus dem Umstand ab, dass gefrorenes CO2 vom festen direkt in den gasförmigen Zustand übergeht (sublimiert), ohne vorher flüssig zu werden. Liegt der Druck in einem Fluid über dem kritischen Punkt (Spitze des Koexistenzgebiets flüssig-gasförmig), wird die Unterscheidung zwischen flüssig und gasförmig hinfällig. Ein Gas, das bei so hohem Druck isotherm komprimiert wird, kann so dicht wie eine Flüssigkeit werden, ohne je einen Flüssigkeitssee zu bilden.
Phasendiagramm
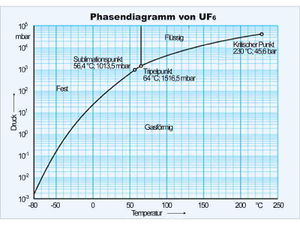
Projiziert man die Zustandsfläche auf die Druck-Temperatur-Ebene, erhält man das Zustands- oder Phasendiagramm. Im Phasendiagramm wird die Tripellinie zum Tripelpunkt und die drei Teilflächen, welche die Koexistenzgebiete darstellen, schrumpfen zu einer y-förmig verzweigten Linie. Diese Linien können nun als Graphen der Funktion p(T) gelesen werden. So ordnet die Dampfdruckkurve (rechter Ast des Y) jeder Temperatur zwischen dem Tripelpunkt und dem kritischen Punkt eindeutig einen Druck zu. Dieser Druck stellt sich bei einer gegebenen Temperatur automatisch ein, solange die flüssige und gasförmige Phase koexistieren. In den Koexistenzgebieten der Zustandsfläche müssen die Isobaren und die Isothermen zusammen fallen und parallel zur V-Achse verlaufen, damit die Projektion im Phasendiagramm einen einzigen Punkt ergibt.
Im nebenstehend abgebildeten Phasendiagramm von Uranhexafluorid ist die Temperatur linear, der Druck dagegen logarithmisch aufgetragen. Die Dampfdruckkurve, die vom Tripelpunkt (64°C, 1.52 bar) zum kritischen Punkt (230°C, 45.6 bar) führt, muss demnach nahezu eine Exponentialfunktion sein. Uranhexafluorid kann nur oberhalb des Tripelpunkt-Drucks von 1.5165 bar als Flüssigkeit existieren. Bei Normaldruck (1.0135 bar) sublimiert das UF6 bei einer Temperatur von 56.4°C. Heizt man UF6 bei Normaldruck und Zimmertemperatur auf, steigt die Temperatur bis auf 56.4°C an. Dann sublimiert der Stoff unter Aufnahme von viel Entropie und einer grossen Volumenänderung. Heizt man das Gas danach isobar auf 250°C auf, erhöht dann den Druck auf 50 bar und kühlt auf 70°C ab, ist das UF6 flüssig, obwohl sich nie ein Zweiphasengemisch (unten Flüssigkeit und oben Gas) gebildet hat.
Arbeitsdiagramm
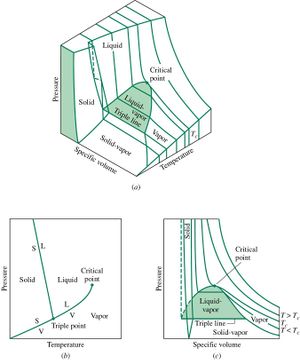
Das Bild zeigt die Zustandsfläche, das Phasendiagramm und das Arbeitsdiagramm von Wasser in nicht massstäblicher Darstellung. Wasser ist insofern ein besonderer Stoff, als die Flüssigkeit weniger Volumen beansprucht als das Eis. Deshalb schwimmen die Eisberge und die Seen gefrieren nur an der Oberfläche. Wäre das Eis schwerer als das Wasser, würde es im Winter nach der Bildung absinken und wäre im Sommer durch das darüber liegende Wasser vor dem Abschmelzen geschützt. Unsere Seen wären dann Eisklötze mit Sommerpfützen. Im Phasendiagramm wird dieses Phänomen durch eine hinten zurück laufende Zylinderfläche für das Koexistenzgebiet fest-flüssig dargestellt. Zudem neigt sich diese Fläche leicht gegen die Druck-Volumen-Ebene, was im Phasendiagramm an der Neigung der zugehörigen Kurve gut zu erkennen ist.
Projiziert man die Zustandsfläche auf die Druck-Volumen-Ebene, gewinnt man das Arbeitsdiagramm. Die Energie, die ein Stoff bei einem bestimmten Prozess in mechanischer Form an die Umgebung abgibt, erscheint in diesem Diagramm als Fläche unter der den Prozess beschreibenden Kurve. Verdampft man zum Beispiel ein Kilogramm Wasser bei Normaldruck, vergrössert sich das Volumen auf 1.67 m3. Die zugehörige Arbeit ist folglich gleich 170 kJ (Druck mal Volumenänderung). Nun beträgt die spezifische Verdampfungsenthalpie 2.256 MJ/kg. Diese Energie muss pro Kilogramm Wasser in Form von Wärme zugeführt werden, damit es verdampft. Weil gleichzeitig 170 kJ in Form von Arbeit an die Umgebung abgegeben wird, ändert sich die innere Energie des Wassers nur um 2.087 MJ.
Luftfeuchtigkeit
Die absolute Luftfeuchtigkeit beschreibt den Anteil des Wasserdampfs am Gasgemisch der Erdatmosphäre und wird meist in g/m3 gemessen. Die relative Luftfeuchtigkeit, angegeben in Prozent, bezeichnet das Verhältnis des momentanen Gehalts an Wasserdampf zum maximal möglichen Dampfgehalt bei derselben Temperatur
- relative Luftfeuchtigkeit = effektive Dichte des Wasserdampfes bei gegebener Temperatur durch maximal mögliche Dichte
Der maximal mögliche Anteil an Wasserdampf in der Luft entspricht in guter Näherung dem Dampf, der sich im thermischen Gleichgewicht bildet, falls das Wasser (ohne Luft) in einem evakuierten Gefäss eingeschlossen ist. Folglich darf der Partialdruck des Wasserdampfes bei 100% Luftfeuchtigkeit direkt der Dampfdruckkurve entnommen werden. Die zugehörige Dichte ist gleich dem Kehrwert des spezifischen Volumens, das man bei gegebener Temperatur am rechten Rand des Zweiphasengebiets flüssig-gasförmig aus der Zustandsfläche herauslesen kann.
Eine wichtige Kenngrösse ist die Temperatur des Taupunkts. Wird feuchte Luft gekühlt, sinkt der maximal mögliche Druck des Wassersdampfs, der Dampfdruck, und auch seine maximal mögliche Dichte ab. Sobald die maximal mögliche Dichte kleiner als die real vorhandene ist, bilden sich an einer Glas- oder Metalloberfläche kleine Tröpfchen.
Heizt man Luft zusammen mit dem darin enthaltenen Wasserdampf auf, sinkt die relative Luftfeuchtigkeit ab, weil die maximal mögliche Dichte des Dampfes steigt. Der unter normalen Bedingungen in der Luft enthaltene Wasserdampf darf in guter Näherung als ideales Gas behandelt werden. Dividiert man die universelle Gasgleichung durch die Masse, erhält man eine Formel, mit welcher der Partialdruck aus der Dichte berechnet werden kann
- [math]p_{H_2O}=\frac{\varrho_{H_2O} RT}{\hat m}=\varrho_{H_2O} R_s T[/math]
wobei Rs die spezifische Gaskonstante bezeichnet.
Entropie
Die Gleichgewichtszustände eines homogenen Stoffs liegen alle auf der Zustandsfläche. Sind spezifisches Volumen und Temperatur gegeben, ist auch der Druck bestimmt. In den Zweiphasengebieten hängt der Druck sogar nur von der Temperatur ab. Als vierte Grösse kommt noch die Entropie dazu. Die spezifische Entropie kann ebenfalls in Funktion des spezifischen Volumens und der Temperatur angegeben werden. Weil so jeder Zustand eines homogenen Stoffs durch zwei aus vier möglichen Variablen festgelegt ist, ergeben sich mehrere Darstellungsformen. Erschwerend kommt hinzu, dass diese Abhängigkeit oft mit Hilfe der inneren Energie und den zugehörigen Hilfsgrössen Enthalpie und freie Energie formuliert wird. Dies ist einer der Gründe, wieso die Thermodynamik als schwieriges Gebiet gilt.
Aber man müsste sich das Leben nicht so schwer machen. Der Carnotor, der alle möglichen Prozesse eines homogenen Stoffes simuliert, ermittelt über die beiden Bilanzgleichungen die aktuellen Werte für Volumen und Entropie. Die zugehörigen Potenziale, der Druck und die Temperatur, sind dann aus den beiden Mengen zu ermitteln. Demnach lässt sich das Verhalten eines Stoffes simulieren, sobald der die Funktionen p(V,S) und T(V,S) bekannt sind.
Wärmepumpe
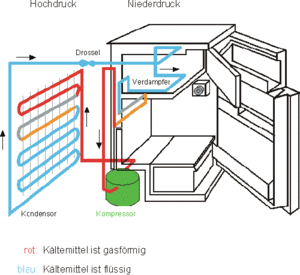
Die Wärmepumpe ist eine Maschine, die Entropie von einem kalten Körper zu einem wärmeren pumpt. Bei der eigentlichen Wärmepumpe wird die bei hoher Temperatur abgegebene Wärme zum Heizen genutzt. Eine Kältemaschine kühlt ein System, indem es diesem Wärme entzieht und auf ein höheres Temperaturniveau pumpt. Bis jetzt haben wir uns nur mit der Wirkweise von Wärmepumpen beschäftigt. Dabei haben Sie gelernt, dass die aufzuwendende Energie gleich Entropie (Menge) mal Temperaturdifferenz (Pumphöhe) ist
- Leistungsbetrachtung: [math]P=\Delta T I_S[/math]
- Energiebetrachtung: [math]W=\Delta T S_{gepumpt}[/math]
Hier sollen nun die inneren Prozesse einer Wärmepumpe erläutert werden. Im Innern einer konventionellen Wärmepumpe wird ein Fluid, Kältemittel genannt, im Kreis herum geführt. Man kann nun ein ausgewähltes Stück dieses Kältemittels, Masse- oder Volumenelement genannt, auf seinem Weg begleiten. Wir beginnen mit unserer Reise vor dem Kompressor. Das Kältemittel, das bei kleinem Druck und tiefer Temperatur im gasförmigen Zustand vorliegt, wird durch den Kompressor näherungsweise isentrop komprimiert. Infolge dieser Aktion steigen der Druck und die Temperatur massiv an. Danach gibt das Kältemittel über einen Wärmetauscher Entropie an ein warmes System ab. Während dieses Vorgangs kühlt das Mittel zuerst etwas ab, dann setzt Kondensation ein. Bei idealer Prozessführung kondensiert das Kältemittel bei konstant hohem Druck vollständig. Danach fliesst das Mittel über eine Drossel, wobei der Druck sinkt. Dadurch verdampft ein kleiner Teil des Mittels und die Temperatur sinkt wieder auf den ursprünglichen Wert ab. In diesem total irreversiblen Prozess bleibt die spezifische Enthalpie erhalten, d.h. die Prozessführung ist isenthalp. Im letzten Teilprozess nimmt das Kältemittel über einen zweiten Wärmetauscher bei tiefer Temperatur und konstant tief gehaltenem Druck Entropie auf, bis es wieder vollständig verdampft ist.
Kontrollfragen
- Wie sehen die Isochoren, die Isentropen, die Isobaren und die Isothermen des idealen Gases im T-S- und im p-V-Diagramm aus?
- Wasser von 10°C wird bei einem konstant gehaltenen Druck von einem Bar auf 150°C erhitzt. Beschreiben Sie diesen Prozess mit Hilfe des Carnotors. Wann bildet sich ein Flüssigkeitsspiegel und wie verändert sich dieser?
- Eine Flüssigkeit wird isobar bis zur Siedetemperatur erhitzt und dann bei konstant gehaltenem Druck verdampft. Danach wird der Dampf isentrop über die kritische Temperatur komprimiert, isotherm auf das ursprüngliche Volumen komprimiert und zum Schluss isochor auf den Anfangswert gekühlt. Beschreiben Sie diesen Kreisprozess mit Hilfe des Carnotors. Wann bildet sich ein Flüssigkeitsspiegel und wie verändert sich dieser?
- Gefrorenes CO2 nennt man Trockeneis, weil es direkt in den gasförmigen Zustand übergeht (sublimiert), ohne zuerst eine Flüssigkeit zu bilden. Unter welchen Umständen wird Kohlendioxid flüssig?
- Luft (zur Hauptsache Stickstoff und Sauerstoff) lässt sich bei Zimmertemperatur durch isotherme Kompression nicht verflüssigen. Wie ist das zu verstehen?
- Was versteht man unter einer Luftfeuchtigkeit von 50%?
- Wieso ist die Luft in den geheizten Räumen meistens sehr trocken und wieso ist die Luft im Keller eher feucht?
- Was passiert mit dem Kältemittel in einer Wärmepumpe während eines Zyklus? Skizzieren Sie das T-S-Diagramm. Wie kann man in diesem Diagramm die aufgenommene und abgegebene Wärme(energie) erkennen?
Antworten zu den Kontrollfragen
- Im T-S-Diagramm bilden die Isothermen und die Isentropen die Koordinatenlinien. Längs den Isochoren und den Isobaren nimmt die Temperatur exponentiell mit der Entropie zu, wobei die Schar der Isochoren steiler als die Schar der Isobaren ist. Im p-V-Diagramm sind die Isobaren und die Isochoren die Koordinatenlinien. Die Isothermen bilden eine Schar von Hyperbeln, die von den Isentropen unter spitzem Winkel geschnitten werden.
- Der Carnotor wird aktiv beheizt und der hydraulische Port ist mit einem Druckgefäss kurz geschlossen. Bis gegen etwa 100°C liegt der Trennkolben satt am Wasser an. Danach wird der Kolben bei konstanter Temperatur weg gedrängt und über dem Wasser bildet sich ein mit Dampf gefüllter Raum. Sobald alles Wasser verdampft ist, steigt die Temperatur weiter an.
- Isobares Heizen: thermischer Port ist aktiv, hydraulischer mit Druckgefäss kurz geschlossen; isentropes Komprimieren: thermischer Port ist blockiert und hydraulischer aktiv; isotherme Kompression: thermischer Port ist mit Wärmebad kurz geschlossen, hydraulischer aktiv; isochores Kühlen: thermischer Port aktiv, hydraulischer blockiert. Beim isobaren Heizen bildet sich während des Verdampfens ein Zweiphasengemisch (flüssig und gasförmig). Danach wird das Gas zuerst bei steigender (isentrop) und danach bei konstanter Temperatur (isotherm) verdichtet. Auch beim nachträglichen Abkühlen bei konstantem Volumen bildet sich nie mehr eine Trennfläche zwischen gasförmigem und flüssigem Stoff.
- Flüssiges Kohlendioxid kann sich nur bilden, falls der Druck über dem Wert des Tripelpunkts von 5.2 bar liegt.
- Weil die Zimmertemperatur höher als die kritische Temperatur von Sauerstoff und Stickstoff ist, macht die Unterscheidung in flüssigen und gasförmigen Zustand keinen Sinn.
- Bei einer Luftfeuchtigkeit von 50% beträgt die Dichte des Wasserdampf 50% des bei dieser Temperatur maximal möglichen Wertes.
- Im Winter wird die von draussen kommende Luft erwärmt. Dabei steigt die maximal mögliche Dichte des Wasserdampfes stark an. Weil sich der in der Luft befindliche Wasserdampf nicht vermehren kann, sinkt die relative Luftfeuchtigkeit. Im Sommer kühlt sich die von draussen kommende Luft im Keller ab. Dadurch sinkt das "Fassungsvermögen" an Wasserdampf und die relative Luftfeuchtigkeit steigt.
- Vergl. Kaltdampfprozess.