Ideales Gas: Unterschied zwischen den Versionen
Admin (Diskussion | Beiträge) (→Modell) |
Admin (Diskussion | Beiträge) |
||
| (10 dazwischenliegende Versionen desselben Benutzers werden nicht angezeigt) | |||
| Zeile 5: | Zeile 5: | ||
Der Zustand des idealen Gases kann auf zwei Arten verändert werden, durch heizen und kühlen oder durch komprimieren und entspannen. Um diese Prozesse kontrolliert ablaufen zu lassen, gehen wir von folgender Anordnung aus. Das Gas befinde sich in einem Zylinder, der mit einem Kolben verschlossen ist. Der Zylinderboden sei ideal wärmedurchlässig (diatherm), besitze aber selber keine [[Wärmekapazität]]. Die Zylinderwände und der Kolben sind absolut wärmeisoliert (adiabatisch). Der reibunsfrei verschiebbare Kolben schliesst das Gas hermetisch gegen eine inkompressible Flüssigkeit ab, welche für den Druckaufbau verantwortlich ist. Diese kleine Maschine, mit der man das Gas heizen bzw. kühlen und komprimieren bzw. kontrolliert entspannen kann, heisst [[Carnotor]]. |
Der Zustand des idealen Gases kann auf zwei Arten verändert werden, durch heizen und kühlen oder durch komprimieren und entspannen. Um diese Prozesse kontrolliert ablaufen zu lassen, gehen wir von folgender Anordnung aus. Das Gas befinde sich in einem Zylinder, der mit einem Kolben verschlossen ist. Der Zylinderboden sei ideal wärmedurchlässig (diatherm), besitze aber selber keine [[Wärmekapazität]]. Die Zylinderwände und der Kolben sind absolut wärmeisoliert (adiabatisch). Der reibunsfrei verschiebbare Kolben schliesst das Gas hermetisch gegen eine inkompressible Flüssigkeit ab, welche für den Druckaufbau verantwortlich ist. Diese kleine Maschine, mit der man das Gas heizen bzw. kühlen und komprimieren bzw. kontrolliert entspannen kann, heisst [[Carnotor]]. |
||
Gelöste Stoffe verhalten sich |
Gelöste Stoffe verhalten sich, solange die Wechselwirkung zwischen den Teilchen keine Rolle spielt, wie ein ideales Gas. Um einen gelösten Stoff zu modellieren, denken wir uns den Kolben durch eine verschiebbare Membran ersetzt, welche für die Flüssigkeit (''Fuid'' der rechten Kammer) durchlässig ist. Die Membran soll aber den gelösten Stoff, der sich nur in der linken Kammer befindet und das Gas ersetzt, nicht durchlassen. Einen dermassen selektiv durchlässigen Kolben nennt man semipermeabel. Auf die semipermeable Membran wirkt damit nur der [[Partialdruck]] des gelösten Stoffes. |
||
Das Systeme Gas besitzt eine direkte thermische und eine indirekte hydraulische Verbindung zur Umgebung. Es kann deshalb mit der Umgebung Energie in Form von Wärme und Arbeit austauschen. |
Das Systeme Gas besitzt eine direkte thermische und eine indirekte hydraulische Verbindung zur Umgebung. Es kann deshalb mit der Umgebung Energie in Form von Wärme und Arbeit austauschen. |
||
| Zeile 150: | Zeile 150: | ||
|- |
|- |
||
|isentrop |
|isentrop |
||
|<math>(\frac{V}{V_0})^R=(\frac{T_0}{T})^{\hat c_V}</math> |
|<math>\left(\frac{V}{V_0}\right)^R=\left(\frac{T_0}{T}\right)^{\hat c_V}</math> |
||
|<math>\Delta S=0</math> |
|<math>\Delta S=0</math> |
||
|<math>\Delta W=n\hat c_V\Delta T</math> |
|<math>\Delta W=n\hat c_V\Delta T</math> |
||
| Zeile 157: | Zeile 157: | ||
|isotherm |
|isotherm |
||
|<math>\frac {V}{V_0}=\frac{p_0}{p}</math> |
|<math>\frac {V}{V_0}=\frac{p_0}{p}</math> |
||
|<math>\Delta S=nR |
|<math>\Delta S=nR\ln\left(\frac{V}{V_0}\right)</math> |
||
|<math>\Delta F=nR T_0 |
|<math>\Delta F=nR T_0\ln\left(\frac{V_0}{V}\right)</math> |
||
|Gesetz von [[Boyle-Mariotte]] |
|Gesetz von [[Boyle-Mariotte]] |
||
|} |
|} |
||
| Zeile 164: | Zeile 164: | ||
Der Ausdruck für die isentrope Zustandsänderung kann mit Hilfe des '''Isentropenexponentes''' <math>\kappa = \frac {\hat c_p}{\hat c_V}</math> umgeschrieben werden |
Der Ausdruck für die isentrope Zustandsänderung kann mit Hilfe des '''Isentropenexponentes''' <math>\kappa = \frac {\hat c_p}{\hat c_V}</math> umgeschrieben werden |
||
:<math>(\frac{V}{V_0})^{\kappa -1}=\frac{T_0}{T}</math> |
:<math>\left(\frac{V}{V_0}\right)^{\kappa -1}=\frac{T_0}{T}</math> |
||
Unter Verwendung der universellen Gasgleichung lässt sich dieser Zusammenhang in eine Form mit den Variablen ''p'' und ''V'' umwandeln |
Unter Verwendung der universellen Gasgleichung lässt sich dieser Zusammenhang in eine Form mit den Variablen ''p'' und ''V'' umwandeln |
||
:<math>(\frac{V}{V_0})^\kappa=\frac{p_0}{p}</math> |
:<math>\left(\frac{V}{V_0}\right)^\kappa=\frac{p_0}{p}</math> |
||
Eine weitere Umformung liefert |
Eine weitere Umformung liefert |
||
:<math>(\frac{p}{p_0})^{\kappa -1}=(\frac{T}{T_0})^\kappa</math> |
:<math>\left(\frac{p}{p_0}\right)^{\kappa -1}=\left(\frac{T}{T_0}\right)^\kappa</math> |
||
Das '''Temperatur-Entropie-''' und das '''Druck-Volumen-Diagramm''' liefern die zentralen Informationen zu den statischen Prozessen. Zeichnet man in beiden Diagrammen die Linien gleichen Volumens (Isochoren, blau), gleicher Entropie (Isentropen, rot), gleichen Drucks (Isobaren, blau gestrichelt) und gleicher Temperatur (Isotheremen, rot gestrichelt) ein, erhält man ein Raster, in dem alle idealisierten Kreisprozesse eingezeichnet werden können. Zudem entspricht die Fläche unter dem ''T-S-''Diagramm der Wärme (thermisch ausgetauschte Energie) und die Fläche unter dem ''p-V-''Diagramm der (negativen) Arbeit (mechanisch ausgetauschte Energie). |
|||
==Arbeit und Wärme== |
|||
[[Bild:Einatomige Gase T-S-Diagramm.gif|thumb|''T-S-''Diagramm]]Aus der Wirkweise des [[Carnotor]]s geht hervor, dass das [[Volumen]] und die [[Entropie]] als Grundmengen der homogenen Stoffe betrachtet werden können. Der Druck und die Temperatur bilden dann die zugehörigen Potenziale. Folglich entspricht die Fläche unter dem ''p-V-''Diagramm der (negativen) Arbeit und die Fläche unter dem ''T-S-''Diagramm der Wärme. Nun kann man die Koordinatenlinien des einen Diagramms als Kurve ins andere übertragen. Mit diesen Kurvenscharen lassen sich ideale Kreisprozesse schnell und recht genau skizzieren. Bei Gasen werden die beiden Basisgrössen Volumen und Entropie oft pro Mol (molar) angegeben. Die verschiedenen Kurven sind durch folgende Gleichungen festgelegt |
|||
Die '''Isobaren''' erscheinen im ''p-V-''Diagramm als horizontale Linien. Im ''T-S-''Diagramm gehen die Isobaren in Exponentialfunktionen über |
|||
:<math>T=T_ne^{\hat s/\hat c_p}</math> |
|||
wobei die spezifische Entropie willkürlich in einem bestimmten Zustand <math>p_0\hat v_0=RT_0</math> gleich Null gesetzt wird. |
|||
Die '''Isochoren''' bilden im ''p-V-''Diagramm die vertikale Linien. Im ''T-S-''Diagramm gehen die Isochoren ebenfalls in Exponentialfunktionen über |
|||
:<math>\hat v=\hat v_ne^{\hat s/\hat c_V}</math> |
|||
wobei auch hier der Nullpunkt der Entropie willkürlich gleich Null gesetzt werden kann. |
|||
[[Bild:Einatomige Gase p-V-Diagramm.gif|thumb|''p-V-''Diagramm]]Die '''Isothermen''' bilden im ''T-S-''Diagramm die horizontalen Koordinatenlinien. Im ''p-V-''Diagramm erscheinen die Isothermen als Hyperbeln |
|||
:<math>p=p_n\frac{\hat v_n}{\hat v}</math> |
|||
Die '''Isentropen''' erscheinen im ''T-S-''Diagramm als vertikale Koordinatenlinien. Im ''p-V-''Diagramm nehmen sie die Form einer Potenzfunktion mit gebrochenem Exponenten an |
|||
:<math>p=p_n\left(\frac{\hat v_n}{\hat v}\right)^\kappa</math> |
|||
In den beiden Diagrammen sind je alle vier Iso-Linien eingetragen (blau die hydraulischen und rot die thermischen). |
|||
==Potenziale== |
|||
[[Bild:Einatomige Gase V-S-Diagramm.gif|thumb|''V-S-''Diagramm]]Aus der Funktionsweise des [[Carnotor]]s geht hervor, dass [[Volumen]] und [[Entropie]] die frei wählbaren Grössen ([[Zustandsgrössen]]) sind. [[Druck]] und [[Temperatur]] ergeben sich dann aus dem jeweiligen Zustand |
|||
:<math>p=f(V,S)</math> und <math>T=g(V,S)</math> |
|||
Diese Funktionen, welche jedem Entropieinhalt und jedem Volumen je ein Potenzial zuordnet, lassen sich wieder mit Hilfe von Isobaren und Isothermen darstellen. Das nebenstehend abgebildete Diagramm zeigt diese Linien gleichen Drucks und gleicher Temperatur über der ''V-S-''Ebene. Mit etwas Fantasie kann man sich die Kurven als eine Art Höhenlinien interpretieren. Dann sieht man förmlich, wie die sowohl Druck als auch Temperatur mit wachsender [[Entropie]] und kleiner werdendem Volumen ansteigen. Die Isobaren verlaufen flacher als die Isothermen, weil beim Heizen mit konstantem Druck die Temperatur steigt. Umgekehrt sinkt der Druck bei der isothermen Expansion. |
|||
==Anwendungen== |
==Anwendungen== |
||
Aktuelle Version vom 23. Juni 2011, 09:15 Uhr
Modell
Das Modell des idealen Gases beschreibt den Zustand von stark verdünnten Stoffen, wobei die Wechselwirkung zwischen den Teilchen dieses Stoffes vernachlässigbar klein sein sollte. Dieses Modell ist auf gasförmige und gelöste Stoffe anwendbar.
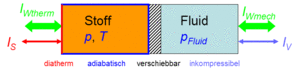
Der Zustand des idealen Gases kann auf zwei Arten verändert werden, durch heizen und kühlen oder durch komprimieren und entspannen. Um diese Prozesse kontrolliert ablaufen zu lassen, gehen wir von folgender Anordnung aus. Das Gas befinde sich in einem Zylinder, der mit einem Kolben verschlossen ist. Der Zylinderboden sei ideal wärmedurchlässig (diatherm), besitze aber selber keine Wärmekapazität. Die Zylinderwände und der Kolben sind absolut wärmeisoliert (adiabatisch). Der reibunsfrei verschiebbare Kolben schliesst das Gas hermetisch gegen eine inkompressible Flüssigkeit ab, welche für den Druckaufbau verantwortlich ist. Diese kleine Maschine, mit der man das Gas heizen bzw. kühlen und komprimieren bzw. kontrolliert entspannen kann, heisst Carnotor.
Gelöste Stoffe verhalten sich, solange die Wechselwirkung zwischen den Teilchen keine Rolle spielt, wie ein ideales Gas. Um einen gelösten Stoff zu modellieren, denken wir uns den Kolben durch eine verschiebbare Membran ersetzt, welche für die Flüssigkeit (Fuid der rechten Kammer) durchlässig ist. Die Membran soll aber den gelösten Stoff, der sich nur in der linken Kammer befindet und das Gas ersetzt, nicht durchlassen. Einen dermassen selektiv durchlässigen Kolben nennt man semipermeabel. Auf die semipermeable Membran wirkt damit nur der Partialdruck des gelösten Stoffes.
Das Systeme Gas besitzt eine direkte thermische und eine indirekte hydraulische Verbindung zur Umgebung. Es kann deshalb mit der Umgebung Energie in Form von Wärme und Arbeit austauschen.
Bilanzen und Prozesse
Das ideal Gas kann über zwei Verbindungen (Portale oder Konnektoren) Entropie und Volumen mit der Umgebung austauschen. Weil das Gas homogen ist und die Verbindungen ideal sind, wird innerhalb des Systems keine Entropie produziert. Folglich kann die Entropiebilanz und die Volumenbilanz in einfachster Form hingeschrieben werden
- [math]\begin{matrix} I_S &=&\dot S\\I_V&=&\dot V_{Fluid}=-\dot V\end{matrix}[/math]
Das ideale Gas kann vier einfach zu realisierende Prozesse durchlaufen. In zwei Prozessen ist je ein Portal geschlossen, in den zwei andern ist das Portal hemmungslos mit der Umwelt verbunden, so dass innen und aussen der gleiche Druck bzw. die gleiche Temperatur herrscht.
| Prozess | Beschreibung | thermisches Portal | hydraulisches Portal |
|---|---|---|---|
| isochor | V =konst | aktiv | geschlossen |
| isobar | p =konst | aktiv | direkt verbunden |
| isentrop | S =konst | geschlossen | aktiv |
| isotherm | T =konst | direkt verbunden | aktiv |
konstitutive Gleichungen
Beim idealen Gas koppeln zwei Bilanzgleichungen über die beiden zugehörigen Potenziale. Im Gegensatz zum Massenpunkt, bei dem die Masse als dreifache Impulskapazität auftritt und ähnlich wie beim starren Körper, bei dem die drei Drehimpulskomponenten über das Massenträgheitsmoment mit den drei Komponenten der Winkelgeschwindigkeit verknüpft sind, lässt sich die Struktur dieser beiden Speichergesetze nicht ganz einfach durchschauen.
Das erste Speichergesetz, die universelle Gasgleichung oder die thermische Zustandsgleichung des idealen Gases, verknüpft die drei direkt messbaren Grössen Druck, Volumen und Temperatur miteinander
- [math]pV=nRT=mR_sT[/math]
Die erste Form basiert auf der Stoffmenge als natürliches Mass für die Menge eines Stoffes, die zweite nimmt die Masse als Hilfsgrösse, um die Menge des Soffes zu quantifizieren. R steht für die universelle Gaskonstante und Rs für die spezifische Gaskonstante, die für jeden Stoff einen andern Wert annimmt.
Das zweit Speichergesetz beschreibt die Entropie in Funktion des Volumens und der Temperatur
- [math]S =S_0+n(R ln \frac{V}{V_0}+\hat c_V ln \frac{T}{T_0})=S_0+m(R_s ln \frac {V}{V_0}+c_V ln \frac{T}{T_0})[/math]
Die molare bzw. spezifische Energiekapazität (c^V bzw. cV) ist für einatomige Gase gleich 3 R / 2 bzw. 3 Rs / 2. Diese Grössen nennt man auch molare bzw. spezifische Wärmekapazität bei konstantem Volumen, weil sie beim Heizen mit konstantem Volumen (isochores Heizen) ein Mass für die zuzuführende Wärmeenergie sind.
Mit Hilfe der universellen Gasgleichung kann das Speichergesetz für die Entropie umgeformt werden in
- [math]S=S_0+n(R ln\frac{p_0}{p}+\hat c_p ln\frac{T}{T_0})=S_0+m(R_s ln \frac{p_0}{p}+c_p ln \frac{T}{T_0})[/math]
vobei c^p oder cp, die molare bzw. spezifische Enthalpiekapazität, um die Gaskonstante grösser ist als die molare bzw. spezifische Wärmekapazität. Diese Grössen heissen auch molare bzw. spezifische Wärmekapazität bei konstantem Druck, weil sie beim Heizen mit konstantem Druck (isobares Heizen) ein Mass für die zuzuführende Wärmeenergie sind.
Bei den vier grundlegenden Prozessen nehmen die beiden konstitutiven Gleichungen die folgende Form an (die Gleichungen müssen unter Berücksichtigung der Nebenbedingungen nach der Zeit abgeleitet werden, damit sie in Form von Änderungsraten eine momentane Beschreibung des Prozesses abgeben)
| Prozess | Gasgleichung | Entropiegesetz | Bemerkung |
|---|---|---|---|
| isochor | [math]V\dot p=n R \dot T[/math] | [math]\dot S=n\hat c_V\frac{\dot T}{T}[/math] | [math]\dot V=0[/math] |
| isobar | [math]p\dot V=nR\dot T[/math] | [math]\dot S=n\hat c_p\frac{\dot T}{T}[/math] | [math]\dot p=0[/math] |
| isentrop | [math]R\frac{\dot V}{V}\hat+c_V \frac{\dot T}{T}=0[/math] | [math]\dot S=0[/math] | erste Gleichung folgt aus Entropiegesetz |
| isotherm | [math]\dot pV+\dot Vp=0[/math] | [math]\dot S=nR\frac{\dot V}{V}[/math] | [math]\dot T=0[/math] |
Energiebilanz
Die Energiebilanz bezüglich eines homogenen, thermischen Systems heisst aus historischen Gründen 1. Hauptsatz. Die Bilanz setzt die Stärke des thermischen Energiestromes (Wärme) und die des mechanischen (Arbeit) gleich der Änderungsrate der inneren Energie
- [math]I_{W_{therm}}+I_{W_{mech}}=\dot W[/math]
Die Energieströme können mit Hilfe des zugeordneten Energiestromes durch die Stromstärke der Primärgrössen und die zugehörigen Potenziale ausgedrückt werden
- [math]T I_S+p I_V=\dot W[/math]
Weil das System reversibel (ohne Entropieproduktion) arbeitet und das Fluid inkompressibel ist, dürfen die Mengenströme über die Entropiebilanz und die Volumenbilanz durch die zugehörigen Änderungsraten ersetzt werden
- [math]T\dot S-p\dot V=\dot W[/math]
Das Minuszeichen beim hydraulischen Teil kommt von der Konstanz der Summe aus Gasvolumen und Fluidvolumen: wenn das Fluidvolumen infolge Zufuhr zunimmt, vermindert sich das Gasvolumen und umgekehrt.
Die letzte Form ermöglicht eine graphische Interpretation der Wärme und der Arbeit bei homogenen und reversiblen Systemen. Die Wärme entpricht der Fläche (Integral) unter der Kurve im T-S-Diagramm und die Arbeit ist gleich der Fläche (negatives Integral) im p-V-Diagramm.
Setzt man in die letzte Form der Energiebilanz das Entropiegesetz für das ideale Gas bei einem isochorem Prozess ein (siehe Tabelle), erhält man folgende Aussage
- [math]I_{W_{therm}}=\dot W=n\hat c_V\dot T[/math]
In einem isochor geführten Prozess ist die Zunahme der inneren Energie gleich der zugeführten Wärme (daher der Name Wärmekapazität bei konstantem Volumen statt einfach und korrekt nur Energiekapazität). Indem man die konstitutiven Gesetze des idealen Gases für eine beliebe Prozessführunge einsetzt, kann man zeigen, dass die innere Energie des Gases immer diese Form hat, also proportional mit der Temperatur zunimmt und unabhängig vom Volumen ist.
Bei isobarer Prozessführung ist die in Form von Wärme zugeführte Energie gleich der Zunahme der inneren Energie plus die Expansionsarbeit des Gases gegen den Kolben (die hydraulische Abgabe von Energie an die Umwelt). Fügt man nun die Enthalpie als eine neue "Energieform" in die Energiebilanz ein, ist die zugeführte Wärme gleich der Enthalpieänderung
- [math]I_{W_{therm}}=\dot W+p_0\dot V=\dot H=n\hat c_p\dot T[/math]
In einem isobar geführten Prozess ist die Zunahme der Enthalpie gleich der zugeführten Wärme (daher der Name Wärmekapazität bei konstantem Druck statt Enthalpiekapazität).
Bei isothermer Prozessführung ist die in Form von Arbeit zugeführte Energie gleich der Änderung der inneren Energie plus die in Form von Wärme an die Umwelt abgegebene Energie. Weil die innere Energie des idealen Gases nicht von der Temperatur abhängt, heben sich bei der isothermen Prozesführung Arbeit und Wärme auf. Fügt man nun die freie Energie als neue "Energieform" in die Energiebilanz ein, ist die zugeführt Arbeit gleich der Änderung der freien Energie
- [math]I_{W_{mech}}=\dot W+T_0\dot S=\dot F[/math]
Die freie Energie kommt unserer Vorstellung von Arbeit sehr nahe. Bei der isothermen Expansion ist die Arbeit gleich der Änderung der freien Energie. Dass diese Energie zusammen mit der Entropie von der Umwelt her zugeführt wird, bemerken wir nicht. Das expandierende Gas nimmt von der Umwelt Energie und Entropie auf, gibt aber nur die Energie weiter und behält die Entropie. So kann Wärme vollständig in Arbeit "umgewandelt" werden.
statische Beschreibung
Die statische Beschreibung einer Zustandsänderung gewinnt man durch die Integration der entsprechenden Prozesse
| Prozess | Gasgleichung | Entropie | Energie | Bemerkung |
|---|---|---|---|---|
| isochor | [math]\frac {p}{p_0}=\frac{T}{T_0}[/math] | [math]\Delta S=n\hat c_V ln\frac{T}{T_0}[/math] | [math]\Delta W=n\hat c_V\Delta T[/math] | Gesetz von Amontons |
| isobar | [math]\frac {V}{V_0}=\frac {T}{T_0}[/math] | [math]\Delta S=n\hat c_p ln\frac{T}{T_0}[/math] | [math]\Delta H=n\hat c_p\Delta T[/math] | Gesetz von Gay-Lussac |
| isentrop | [math]\left(\frac{V}{V_0}\right)^R=\left(\frac{T_0}{T}\right)^{\hat c_V}[/math] | [math]\Delta S=0[/math] | [math]\Delta W=n\hat c_V\Delta T[/math] | [math]\kappa=\frac{\hat c_p}{\hat c_V}[/math] |
| isotherm | [math]\frac {V}{V_0}=\frac{p_0}{p}[/math] | [math]\Delta S=nR\ln\left(\frac{V}{V_0}\right)[/math] | [math]\Delta F=nR T_0\ln\left(\frac{V_0}{V}\right)[/math] | Gesetz von Boyle-Mariotte |
Der Ausdruck für die isentrope Zustandsänderung kann mit Hilfe des Isentropenexponentes [math]\kappa = \frac {\hat c_p}{\hat c_V}[/math] umgeschrieben werden
- [math]\left(\frac{V}{V_0}\right)^{\kappa -1}=\frac{T_0}{T}[/math]
Unter Verwendung der universellen Gasgleichung lässt sich dieser Zusammenhang in eine Form mit den Variablen p und V umwandeln
- [math]\left(\frac{V}{V_0}\right)^\kappa=\frac{p_0}{p}[/math]
Eine weitere Umformung liefert
- [math]\left(\frac{p}{p_0}\right)^{\kappa -1}=\left(\frac{T}{T_0}\right)^\kappa[/math]
Das Temperatur-Entropie- und das Druck-Volumen-Diagramm liefern die zentralen Informationen zu den statischen Prozessen. Zeichnet man in beiden Diagrammen die Linien gleichen Volumens (Isochoren, blau), gleicher Entropie (Isentropen, rot), gleichen Drucks (Isobaren, blau gestrichelt) und gleicher Temperatur (Isotheremen, rot gestrichelt) ein, erhält man ein Raster, in dem alle idealisierten Kreisprozesse eingezeichnet werden können. Zudem entspricht die Fläche unter dem T-S-Diagramm der Wärme (thermisch ausgetauschte Energie) und die Fläche unter dem p-V-Diagramm der (negativen) Arbeit (mechanisch ausgetauschte Energie).
Arbeit und Wärme
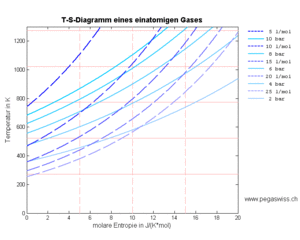
Aus der Wirkweise des Carnotors geht hervor, dass das Volumen und die Entropie als Grundmengen der homogenen Stoffe betrachtet werden können. Der Druck und die Temperatur bilden dann die zugehörigen Potenziale. Folglich entspricht die Fläche unter dem p-V-Diagramm der (negativen) Arbeit und die Fläche unter dem T-S-Diagramm der Wärme. Nun kann man die Koordinatenlinien des einen Diagramms als Kurve ins andere übertragen. Mit diesen Kurvenscharen lassen sich ideale Kreisprozesse schnell und recht genau skizzieren. Bei Gasen werden die beiden Basisgrössen Volumen und Entropie oft pro Mol (molar) angegeben. Die verschiedenen Kurven sind durch folgende Gleichungen festgelegt
Die Isobaren erscheinen im p-V-Diagramm als horizontale Linien. Im T-S-Diagramm gehen die Isobaren in Exponentialfunktionen über
- [math]T=T_ne^{\hat s/\hat c_p}[/math]
wobei die spezifische Entropie willkürlich in einem bestimmten Zustand [math]p_0\hat v_0=RT_0[/math] gleich Null gesetzt wird.
Die Isochoren bilden im p-V-Diagramm die vertikale Linien. Im T-S-Diagramm gehen die Isochoren ebenfalls in Exponentialfunktionen über
- [math]\hat v=\hat v_ne^{\hat s/\hat c_V}[/math]
wobei auch hier der Nullpunkt der Entropie willkürlich gleich Null gesetzt werden kann.
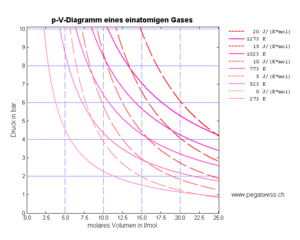
Die Isothermen bilden im T-S-Diagramm die horizontalen Koordinatenlinien. Im p-V-Diagramm erscheinen die Isothermen als Hyperbeln
- [math]p=p_n\frac{\hat v_n}{\hat v}[/math]
Die Isentropen erscheinen im T-S-Diagramm als vertikale Koordinatenlinien. Im p-V-Diagramm nehmen sie die Form einer Potenzfunktion mit gebrochenem Exponenten an
- [math]p=p_n\left(\frac{\hat v_n}{\hat v}\right)^\kappa[/math]
In den beiden Diagrammen sind je alle vier Iso-Linien eingetragen (blau die hydraulischen und rot die thermischen).
Potenziale
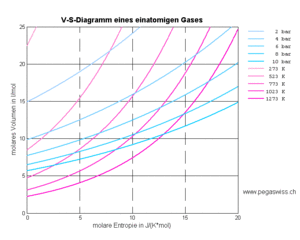
Aus der Funktionsweise des Carnotors geht hervor, dass Volumen und Entropie die frei wählbaren Grössen (Zustandsgrössen) sind. Druck und Temperatur ergeben sich dann aus dem jeweiligen Zustand
- [math]p=f(V,S)[/math] und [math]T=g(V,S)[/math]
Diese Funktionen, welche jedem Entropieinhalt und jedem Volumen je ein Potenzial zuordnet, lassen sich wieder mit Hilfe von Isobaren und Isothermen darstellen. Das nebenstehend abgebildete Diagramm zeigt diese Linien gleichen Drucks und gleicher Temperatur über der V-S-Ebene. Mit etwas Fantasie kann man sich die Kurven als eine Art Höhenlinien interpretieren. Dann sieht man förmlich, wie die sowohl Druck als auch Temperatur mit wachsender Entropie und kleiner werdendem Volumen ansteigen. Die Isobaren verlaufen flacher als die Isothermen, weil beim Heizen mit konstantem Druck die Temperatur steigt. Umgekehrt sinkt der Druck bei der isothermen Expansion.