Joule-Zyklus
Der Joule-Kreisprozess oder Brayton-Kreisprozess ist eine Idealisierung des in Gasturbinen und Strahltriebwerken ablaufenden Vorganges. Der Joule-Zyklus setzt sich aus zwei isentropen und zwei isobaren Zustandsänderungen zusammen.
Beschreibung
Im idealen Joule-Zyklus oder Joule-Kreisprozess wird das Gas isentrop kompimiert, isobar geheizt, isentrop entspannt und zum Schluss isobar gekühlt
- 1 - 2 isentrope Kompression (spezifische Entropie bleibt konstant)
- 2 - 3 isobares Heizen (Druck bleibt konstant)
- 3 - 4 isentrope Expansion (spezifische Entropie bleibt konstant)
- 4 - 1 isobares Kühlen (Druck bleibt konstant)
| Zustandsdiagramme | |
|---|---|
 |
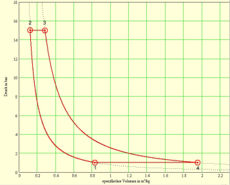 |
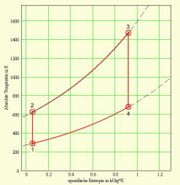
Die Fläche unter dem T-S-Diagramm entspricht der Wärme (thermisch ausgetauschte Energie) und die Fläche unter dem p-V-Diagramm der (negativen) Arbeit (mechanisch ausgetauschte Energie). Die ausgeschnittene Fläche ergibt in beiden Diagrammen die mechanisch frei gesetzte Energie. Die beiden Basisprozesse, aus denen der Joule-Zyklus zusammengesetzt wird, lassen sich thermisch, kalorisch oder entropisch beschreiben
| Prozess | thermisch | entropisch | energetisch | Bemerkung |
|---|---|---|---|---|
| isobar | [math]\frac {v}{v_0}=\frac {T}{T_0}[/math] | [math]\Delta s=c_p ln\frac{T}{T_0}[/math] | [math]\Delta h=c_p\Delta T[/math] | Gesetz von Gay-Lussac |
| isentrop | [math](\frac{v}{v_0})^{R_s}=(\frac{T_0}{T})^{c_V}[/math] | [math]\Delta s=0[/math] | [math]\Delta w=c_V\Delta T[/math] | [math]\kappa=\frac{c_p}{c_V}[/math] |
Die mengenartigen Grössen Entropie, Volumen, Energie und Enthalpie sind klein geschrieben, weil damit spezifische Grössen (Menge pro Masse) gemeint sind. Die Wärmekapazität bei konstantem Volumen cV und bei konstantem Druck cp sowie die Gaskonstante Rs sind ebenfalls auf die Masse bezogen (spezifisch). Die thermische Beschreibung für die isentrope Zustandsänderung kann mit Hilfe des Isentropenexponentes [math]\kappa = \frac {c_p}{c_V}[/math] umgeschrieben werden
- [math](\frac{v}{v_0})^{\kappa -1}=\frac{T_0}{T}[/math]
Unter Verwendung der spezifischen Gasgleichung [math]pv=R_sT[/math] oder [math]p=\varrho R_sT[/math] lässt sich dieser Zusammenhang in eine Form mit den Variablen p und v umwandeln
- [math](\frac{v}{v_0})^\kappa=\frac{p_0}{p}[/math]
Eine weitere Umformung liefert
- [math](\frac{p}{p_0})^{\kappa -1}=(\frac{T}{T_0})^\kappa[/math]
maximale Leistung
In vielen Fällen (Gasturbinen, Strahltriebwerke) sind Druck und Temperatur im Punkt eins gegeben. Zudem darf die Gastemperatur beim Eintritt in die Turbine T3 einen bestimmten Wert Wert nicht überschreiten, weil sonst die Schaufeln beschädigt würden. Damit bleibt noch eine Grösse, der Druck nach dem Kompressor p2, der frei gewählt werden kann. Komprimiert man nur ganz wenig, darf lange geheizt werden, bis die maximale Turbineneintritts-Temperatur erreicht wird. Die vom Joule-Zyklus umrandete Fläche, die Nettoarbeit pro Kilogramm Luft, bildet dann im T-S-Diagramm eine schmale Sichel und im p-v-Diagramm ein flaches Rechteck mit zwei kurzen, gebogenen Kanten, den Isentropen. Wird die Luft komprimiert, bis sie beim Austritt aus dem Kompressor beinahe die Maximaltemperatur erreicht hat, darf sie nur noch wenig geheizt werden. Die umrandete Fläche bildet dann im T-S-Diagramm ein schmales Rechteck mit zwei gebogenen, kurzen Kanten, den Isobaren. Im p-v-Diagramm bildet die umrandete Fläche dann eine Sichel. Zwischen diesen beiden Prozessführungen liegt ein Optimum, bei dem die Energie pro Kilogramm Gas maximal wird. Geht man von einem kontinuierlichen Gasstrom aus, ist dann die maximal mögliche Leistung unter den gegebenen Randbedingungen (minimaler Druck sowie tiefste und höchste Temperatur) erreicht.
Wirkungsgrad
Simulation
Der Joule-Zyklus kann mit Hilfe des Carnotor simuliert werden. Die nachfolgenden Bilder zeigen das Systemdiagramm des Carnotors, die Gleichungen sowie die beiden Zustandsdiagramme, das Temperatur-Entropie-Diagramm und das Druck-Volumen-Diagramm.
-
Systemdiagramm (flowchart)
-
Gleichungen
-
T-S-Diagramm
-
p-V-Diagramm